
 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.分析 A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的p能级中有1个电子,则D元素原子电子排布式为1s22s22p6 3s23p1,故D为Al元素.
(1)A元素的原子最外层电子排布为1s1,则A为氢或Na元素等,可以与氧元素形成水、氧化钠等;
(2)氧原子核外电子数为8,根据核外电子排布规律书写;
(3)若A元素的原子最外层电子排布为1s1,则A为H元素,与O元素形成的含有配位键微粒为H3O+;
(4)当n=2时,B为碳元素,BC2为CO2,结构式为O=C=O;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
(3)根据均摊法计算晶胞中Al、Fe原子数目,确定晶体的化学式,进而计算晶胞的质量,根据ρ=$\frac{m}{V}$计算晶体的密度.
解答 解:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的p能级中有1个电子,则D元素原子电子排布式为1s22s22p6 3s23p1,故D为Al元素.
(1)A元素的原子最外层电子排布为1s1,则A为氢或Na元素等,可以与氧元素形成共价键化合物--水等,可以形成离子化合物--氧化钠、过氧化钠等,故答案为:③;
(2)氧原子核外电子数为8,核外电子排布为1s22s22p4,故答案为:1s22s22p4;
(3)若A元素的原子最外层电子排布为1s1,则A为H元素,与O元素形成的含有配位键微粒为H3O+,故答案为:H3O+;
(4)当n=2时,B为碳元素,BC2为CO2,结构式为O=C=O,含有2个σ键、2个π键;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,
故答案为:2;2;原子晶体;
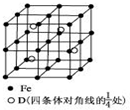
(3)晶胞中Al原子数目为4、Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$+12×$\frac{1}{4}$=8,Al、Fe原子数目之比为1:2,故晶体的化学式为Fe2Al,晶胞的质量为$\frac{4×27+8×56}{6.02×1{0}^{23}}$g,晶胞质量为(a×10-7cm)3,则晶体的密度为:$\frac{4×27+8×56}{6.02×1{0}^{23}}$g÷(a×10-7cm)3=$\frac{0.92}{{a}^{3}}$g/cm3,
故答案为:Fe2Al;$\frac{0.92}{{a}^{3}}$.
点评 本题是对物质结构的考查,涉及核外电子排布规律、化学键、晶体类型、晶胞计算等,难度中等,注意基础知识的理解掌握.


科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列事实不能说明亚硝酸(HNO2)是弱电解质的是( )
A.HNO2不跟NaCl反应
B.NaNO2溶液的pH大于7
C.常温下0.l mol•L-1 HNO2溶液的pH为2.145
D.相同温度下,用相同浓度的HCl溶液和HNO2溶液作导电试验,HNO2溶液灯泡较暗
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O (l) 2H2(g)+O2(g) △H=+285.5k•Jmol-1
2H2(g)+O2(g) △H=+285.5k•Jmol-1
B.反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6k•Jmol-1
2NH3(g)△H=-38.6k•Jmol-1
D.由C(石墨,s)=C(金刚石,s)△H=+1.90k•Jmol-1可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中K+、Mg2+、H+、NO3-不能大量共存 | |
| B. | 溶液中的NH4+与Fe3+均发生水解反应,且相互促进 | |
| C. | 加入金属铜与Fe3+反应的离子方程式为:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 向其中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
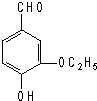
| A. | 1 mol乙基香草醛最多可与1 mol氢气发生加成反应 | |
| B. | 乙基香草醛可与Br2的CCl4溶液发生加成反应 | |
| C. | 1mol乙基香草醛可与含3 mol NaOH的水溶液完全反应 | |
| D. | 乙基香草醛能被酸性高锰酸钾、银氨溶液、新制的氢氧化铜等氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
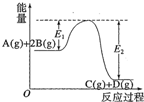
| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 | |
| D. | 1molA(g)和2molB(g)充分反应后放热QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲表示反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com