
 已知X、Y是两种性质相似的短周期元素.
已知X、Y是两种性质相似的短周期元素. ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族. ,X是形成化合物种类最多的元素.
,X是形成化合物种类最多的元素.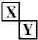 ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.分析 已知X、Y是两种性质相似的短周期元素.
Ⅰ.若X、Y是同周期相邻相似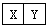 ,它们的单质都必须采用电解法制备,但都无需密封保存,结合位置关系可知,则X为Mg、Y为Al;
,它们的单质都必须采用电解法制备,但都无需密封保存,结合位置关系可知,则X为Mg、Y为Al;
Ⅱ.若X、Y是同族相似$\frac{X}{Y}$,X是形成化合物种类最多的元素,则X为碳元素,Y为Si.
(3)已知:①2I2(s)+5O2(g)=2I2O5(s)△H=-75.66kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
根据盖斯定律,(②×5-①)÷2可得:5CO(g)+I2O5(s)=5 CO2(g)+I2(s);
(4)隔绝空气时SiO和NaOH溶液反应,产物之一是Na2SiO3,还生成氢气;
Ⅲ.若X、Y是对角相似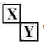 ,X、Y的最高价含氧酸的浓溶液都有强氧化性,则X为N元素、Y为S元素.
,X、Y的最高价含氧酸的浓溶液都有强氧化性,则X为N元素、Y为S元素.
(5)铁片在冷的浓硝酸、浓硫酸中发生钝化,铜片、木炭与浓硝酸及浓硫酸反应,而二氧化硫不能与浓硫酸反应;
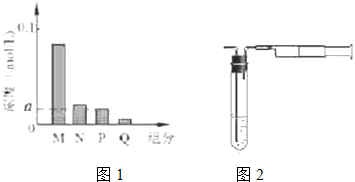
(6)HA是含有X元素的一元酸,常温下,将0.2mol/L的HA溶液与等体积、等浓度的NaOH溶液混合,发生反应:HA+NaOH=NaA+H2O,反应后溶液中钠离子浓度为:c(Na+)=0.2mol/L×$\frac{1}{2}$=0.1mol/L,若HA为强酸,则反应生成溶液为中性,存在离子有:Na+、A-、OH-、H+四种,根据图象可知,M的浓度小于0.1mol/L,则反应后的溶液中至少存在5种粒子,所以HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+);
(7)二氧化硫用碘溶液来吸收,方程式为:SO2+I2+2H2O═2HI+H2SO4,结合反应的方程式计算.
解答 解:已知X、Y是两种性质相似的短周期元素.
Ⅰ.若X、Y是同周期相邻相似 ,它们的单质都必须采用电解法制备,但都无需密封保存,结合位置关系可知,则X为Mg、Y为Al,
,它们的单质都必须采用电解法制备,但都无需密封保存,结合位置关系可知,则X为Mg、Y为Al,
(1)Mg2+离子的结构示意图为: ,故答案为:
,故答案为: ;
;
(2)Al元素在周期表中位置:第三周期ⅢA族,故答案为:第三周期ⅢA族;
Ⅱ.若X、Y是同族相似$\frac{X}{Y}$,X是形成化合物种类最多的元素,则X为碳元素,Y为Si.
(3)已知:①2I2(s)+5O2(g)=2I2O5(s)△H=-75.66kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
根据盖斯定律,(②×5-①)÷2可得:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.17kJ/mol,
故答案为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.17kJ/mol;
(4)隔绝空气时SiO和NaOH溶液反应,产物之一是Na2SiO3,还生成氢气,反应离子方程式为:,
故答案为:SiO+2OH-=SiO32-+H2↑;
Ⅲ.若X、Y是对角相似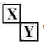 ,X、Y的最高价含氧酸的浓溶液都有强氧化性,则X为N元素、Y为S元素.
,X、Y的最高价含氧酸的浓溶液都有强氧化性,则X为N元素、Y为S元素.
(5)铁片在冷的浓硝酸、浓硫酸中发生钝化,铜片、木炭与浓硝酸及浓硫酸反应,说明浓硫酸、浓硝酸具有强氧化性,而二氧化硫不能与浓硫酸反应,不能说明浓硫酸具有强氧化性,
故选:ABD;
(6)HA是含有X元素的一元酸,常温下,将0.2mol/L的HA溶液与等体积、等浓度的NaOH溶液混合,发生反应:HA+NaOH=NaA+H2O,反应后溶液中钠离子浓度为:c(Na+)=0.2mol/L×$\frac{1}{2}$=0.1mol/L,若HA为强酸,则反应生成溶液为中性,存在离子有:Na+、A-、OH-、H+四种,根据图象可知,M的浓度小于0.1mol/L,则反应后的溶液中至少存在5种粒子,所以HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),即M为A-,N为OH-,P为HA,Q为H+,
故答案为:OH-;
(7)二氧化硫用碘溶液来吸收,方程式为:SO2+I2+2H2O═2HI+H2SO4,为说明该地空气中的SO2含量符合排放标准,设至少抽气x次,则抽气x次SO2的质量为100x×10-3L×2×10-5 g•L-1=(2x×10-6)g,根据化学方程式可得:
SO2~~~~~~~~~~~I2
64 g 1 mol
2x×10-6 g 10×10-3 L×5×10-4 mol•L-1
64 g:2x×10-6 g=1 mol:10×10-3 L×5×10-4 mol•L-1
解得x=160,
故答案为:160.
点评 本题考查结构性质位置关系、热化学方程式书写、离子浓度等效比较、化学方程式计算等,是对学生综合能力的考查,需要学生具备扎实的基础.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
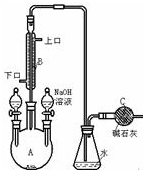 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
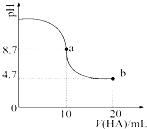 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10ml时,$\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 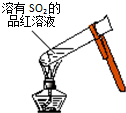 加热后溶液颜色变为无色 加热后溶液颜色变为无色 | |
| B. | 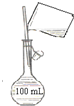 配制100 mL 0.10 mol•L-1NaCl溶液 配制100 mL 0.10 mol•L-1NaCl溶液 | |
| C. | 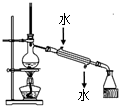 实验室用该装置制取少量蒸馏水 实验室用该装置制取少量蒸馏水 | |
| D. | 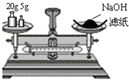 称量25 g NaOH 称量25 g NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠溶液中通入少量二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- | |
| B. | 向NaAlO2溶液中通过量CO2:AlO2-+CO2+H2O═Al(OH)3↓+CO32- | |
| C. | 电路板腐蚀液中的反应:Cu+2Fe3+═2Fe2++Cu2+ | |
| D. | 小苏打溶液与NaOH溶液混合:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com