
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
正极附近的SO浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1~4.4)作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为51.52%,其余为氧,该化合物分子中最多含羰基结构的个数( )
A.2个 B.3个 C.4个 D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修2:化学与技术】(15分)
利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石[(Ca3(PO4)2)]制取硫酸并联产水泥的工艺流程如下:
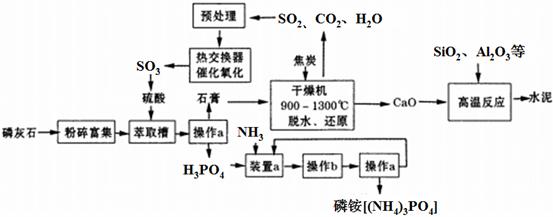
(D操作a的名称 ,实验室中进行此操作时用到的玻璃仪器有
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为 。
(4)水泥常用做建筑材料,是利用了水泥的 性质。
(5)SO2的催化氧化反应为2SO2(g)十O2(g)  2SO3(g)。实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2SO3(g)。实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
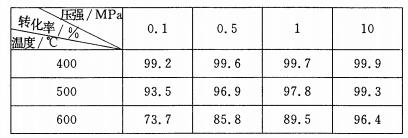
①实际生产中,SO2的催化氧化反应是在常压、400℃ —500℃ 条件下进行。采用常压的主要原因是 ;该反应化学平衡常数大小关系是:K(400℃ ) K(500℃)(填“>”、“<”或“=” )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是 。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液
c、碘水、淀粉溶液 d、KMnO4溶液、稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.所有主族元素的正化合价数,等于它的族序数
B.第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.第ⅠA、第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有非金属元素12种
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴(填序号) 在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2 ⑥Ar中只含有离子键的是 ,只
含有共价键的是 ,既含离子键又含共价键的是 ,没有化学键的是 。
(2)写出下列物质的电子式:
CO2 NaCl H2O2
(3)用电子式表示下列化合物的形成过程:
CaF2: NH3:
查看答案和解析>>
科目:高中化学 来源: 题型:
由Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少一部分。将上述混合物在空气中加热,有气体放出,下列判断正确的是
( )
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
铝与过量的稀盐酸反应,为了减缓反应速率,但是又不影响生成的氢气总量,下列采取措施不能达到实验目的的是( )
A.加入一定体积的NaCl溶液 B.加入一定体积的KNO3饱和溶液
C.加入少量的Na2CO3固体 D.加入少量的NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中一种或几种,取10.6g样品,加入足量的稀盐酸产生气体4.8g,下列分析正确的是()
| A. | 一定含有NaHCO3 | B. | 一定含有K2CO3 | |
| C. | 一定不含NaCl | D. | 一定含有NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com