
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
分析 氯气溶于水与水反应生成氯化氢和次氯酸,发生Cl2+H2O═HCl+HClO;
氯气为黄绿色气体,氯化氢溶于水生成盐酸,盐酸能够与碳酸钠反应生二氧化碳气体,氯离子能够与硝酸银反应生成氯化银沉淀,次氯酸具有漂白性,能够使有色物质褪色,以此解答该题.
解答 解:(1)加入硝酸银生成白色AgCl沉淀,可证明氯水中含有Cl-,故答案为:氯水中含有Cl-;
(2)氯水中含有次氯酸,具有漂白性,可使有色布条褪色,氯气和水反应生成盐酸和次氯酸,盐酸与碳酸钠反应生成二氧化碳球,
故答案为:有色布条褪色;有气泡生成;
(3)氯水中存在氯气和次氯酸,都具有强氧化性,都可能使有色布条褪色,如检验干燥的氯气是否具有漂白性,可用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确,
故答案为:Cl2具有漂白性;HClO具有漂白性;用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确,
(4)如氯水久置与空气中,则次氯酸分解生成盐酸和氧气,变质后的溶液含有盐酸,对实验无影响,故答案为:①③.
点评 本题以氯气的性质为载体综合考查物质含量的测定,侧重于实验现象探究反应本质,根据反应本质揭示反应现象的规律的探究,注重于学生实验能力和探究能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 明矾净水过程中涉及化学变化 | |
| C. | Fe(OH)3胶体与食盐溶液混合将产生聚沉观象 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,可形成带正电荷的胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
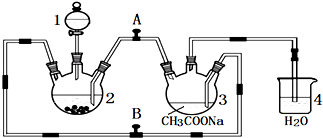
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
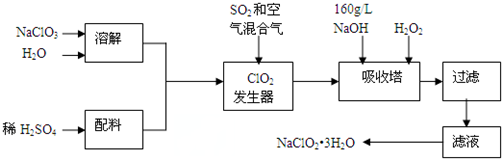
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
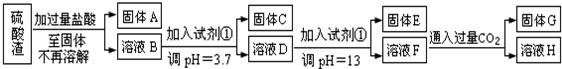
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
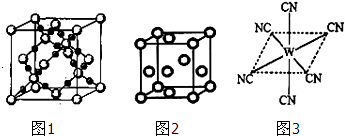
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com