
| A. | SO2既可做氧化剂,又可做还原剂 | |
| B. | SO2是硫酸的酸酐 | |
| C. | 大气中SO2的主要来源是汽车排出的尾气 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
分析 A.二氧化硫中S元素化合价处于中间价态;
B.二氧化硫属于酸性氧化物,能和水反应生成亚硫酸,为亚硫酸的酸酐;
C.二氧化硫主要来源含硫物质的燃烧;
D.SO2具有漂白性,能使品红褪色.
解答 解:A.二氧化硫中S元素为+4价,处于中间价态,既能被氧化又能被还原,能被酸性高锰酸钾溶液等强氧化剂氧化,能被硫化氢等还原,所以既可以作氧化剂又可以作还原剂,故A正确;
B.酸酐是酸失去1分子水后的氧化物,则硫酸的酸酐为三氧化硫,亚硫酸的酸酐为二氧化硫,故B错误;
C.二氧化硫主要来源含硫物质的燃烧,汽车尾气中主要含氮的氧化物,故C错误;
D.SO2具有漂白性,能使品红褪色,但不能使石蕊试液褪色,遇石蕊试液变红,故D错误;
故选A.
点评 本题考查二氧化硫的性质、来源等知识点,二氧化硫具有氧化性、还原性和漂白性,易错选项是D,注意二氧化硫不能漂白酸碱指示剂,为易错点.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 化石燃料等传统能源不能再生,故传统能源都为一次能源,新能源都是二次能源 | |
| B. | 铝热反应需要能量引发,因为铝热反应为吸热反应 | |
| C. | 增加炼铁高炉的高度可以减轻温室效应,因CO2密度较大 | |
| D. | 增加炼铁高炉的高度并不能减少CO的排放,因为没有改变反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
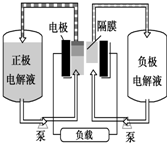 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M=N | B. | M>N | C. | M<N | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe2+的溶液:Na+、NH4+、ClO-、SO42- | |
| B. | 含有大量氨水的溶液:Ca2+、Mg2+、Ba2+、NO3- | |
| C. | 含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- | |
| D. | 含有大量NO3-的溶液:H+、I-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2水溶液能导电,所以SO2是电解质 | |
| B. | NaCl溶液能导电所以NaCl溶液是电解质 | |
| C. | 向醋酸溶液中加入少量氢氧化钠固体,溶液的导电能力降低 | |
| D. | Na2CO3既是钠盐又是碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com