
【题目】—定条件下,CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
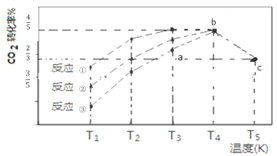
A. a 点 v(正)>v(逆)
B. b点反应放热53.7 kJ
C. 催化剂效果最佳的反应是③
D. c点时该反应的平衡常数K=4/3(mol-2![]() L-2)
L-2)
科目:高中化学 来源: 题型:
【题目】镍是重要的合金元素,可制作镍铬、镍铝等合金,镍也常用作有机加氢的催化剂及制取配合物。
(1)写出基态Cr的简化电子排布式__________,Cr中共有__________种不同能级的电子。
(2)Ni(CO)n与Fe(CO)5同属金属羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。
①Ni、C、O的电负性由大到小的顺序为____________________。
② Ni(CO)n分子中n=__________。
③已知Ni2+和Fe2+的离子半径分别为69pm和78pm,根据岩浆晶出规则熔融的NiO和FeO岩浆在冷却过程中,NiO更容易先结晶,试解释其原因____________________。
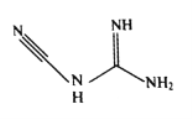
(3)检定镍、钴、铜钯等可用双氰胺,化学式C2H4N4,其结构简式如图所示。双氰胺分子中碳原子的杂化方式有__________,分子结构中键能最大的共价键是__________。
(4)镍的晶体结构、镍铝合金的晶胞如图所示。
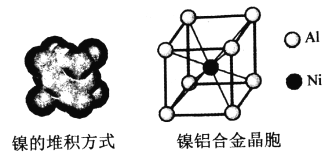
①镍晶体的堆积方式为__________。
②已知Al的第一、第二电离能分别为:l1=578kJ/mol,l2=1817kJ/mol,简述l2远大于l1的原因__________________________________________________。
③已知:镍铝合金密度为dg/cm3,NA代表阿伏伽德罗常数,则铝镍的核间距为__________ pm。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示,下列说法不正确的是 ( )
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A. 盐酸的物质的量浓度为3.0 mol·L-1 B. 根据表中数据能计算出混合物中NaHCO3的质量分数
C. 加入9.2g固体混合物时盐酸过量 D. 15.7g固体混合物恰好与盐酸完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是____________________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:____________________。
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式:_______________;CH3COOH分子中碳原子的杂化类型为_________________;乙醇和丙烷相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:____________________________________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:(![]() ,0,0)、(0,
,0,0)、(0, ![]() ,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为
,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
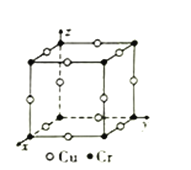
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列计算:
(1)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需KCl的质量为________g。
(2)在K2SO4和Al2(SO4)3的混合溶液中,测得Al3+的浓度为0.2molL﹣1,加入等体积0.6molL﹣1的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中K+的浓度为_____molL﹣1。
(3)某固态化合物X受热分解的反应为:X=A↑+B↑+C↑,在一定的温度和压强下测得反应生成的混合气体对氢气的相对密度为15,则X的摩尔质量是___________。
(4)标准状况下,将V L A气体(摩尔质量为M molL﹣1)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为____________molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃PMMA[结构简式为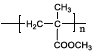 的一种合成路线如下:
的一种合成路线如下:
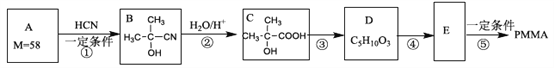
请按照要求回答下列问题:
(1)A属于酮类,其结构简式为________,反应①的类型是___________,E的分子式为_________。
(2)反应③的化学方程式_______________。
(3)检验E中官能团所需试剂及其对应的现象_______________。
(4)已知有机物F的结构简式为![]() 。
。
①以苯酚为主要原料,其他无机试剂根据需要选择,应用上述流程相关信息,设计合成F的路线:_______________。
②写出符合下列条件的F的所有同分异构体的结构简式_______________。
i. 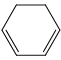 的二取代物
的二取代物
ii. 能与NaHCO3溶液反应产生CO2
iii.核磁共振氢谱有4个吸收峰,且峰面积之比为6:2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。

回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶质的质量分数 | 溶液的密度/gcm-3 | |
硫酸 | c1 | w1 | ρ1 |
氨水 | c2 | w2 | ρ2 |

(1)表中硫酸的质量分数w1为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______mol·L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____ρ2 gcm-3。
(4)标况下700体积的氨气溶解于1体积水中形成氨水饱和溶液,溶液的密度为d g/cm3,则该溶液的物质的量浓度为________(用含有d的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com