
| A. | 硫酸 | B. | 碘水 | C. | 硝酸锌 | D. | 氯化铜 |
分析 铁屑溶于盐酸后,溶液中主要是H+、Cl-、Fe2+,若要将Fe2+变为Fe3+,需要强氧化性物质,据此分析.
解答 解:二价铁离子变为三价铁离子发生了氧化反应,应加入氧化性的物质,在H+存在的情况下,NO3-表现强氧化性,发生反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;硫酸必须是浓硫酸才有强氧化性,稀硫酸没有氧化性;碘水不能氧化亚铁离子;Cu2+氧化性很弱,不能氧化二价铁离子;故C正确;
故选:C.
点评 本题考查了铁及其化合物的性质,熟悉氧化还原反应的规律是解题关键,需要注意的是在H+存在的情况下,NO3-表现强氧化性,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
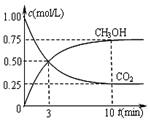 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
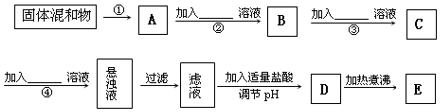
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④ | C. | ①②⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭除去冰箱中的异味 | B. | 用米汤检验含碘食盐中的KIO3 | ||
| C. | 用食醋除去热水壶中的水垢 | D. | 用NaOH溶液鉴别地沟油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝粉投入到NaOH溶液中:2Al+6H2O+2OH-═2 Al(OH)4-+H2↑ | |
| B. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═Al(OH)4- | |
| C. | NaAl(OH)4溶液中通入足量的CO2:2 Al(OH)4-+CO2═2Al(OH)3↓+CO32-+H2O | |
| D. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2 Al(OH)4-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
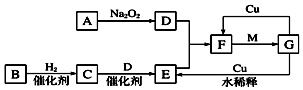
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
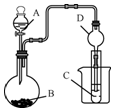 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com