
将10.7 g Mg、Al和Fe组成的合金溶于足量的氢氧化钠溶液中,产生标准状况下3.36 L气体。另取等质量的合金溶于过量盐酸中,生成标准状况下7.84 L气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀物质的量为
A.0.1 mol B.0.2 mol C.0.25 mol D.0.3 mol
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列各项表达中正确的是
A.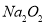 的电子式为
的电子式为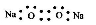
B.16g甲烷完全燃烧生成的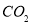 为11.2L(标准状况)
为11.2L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.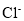 的结构示意图为
的结构示意图为
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安地区八校高三下学期联考三理综化学试卷(解析版) 题型:填空题
(15分)将废旧锌锰电池处理得到含锰混合物,现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示:
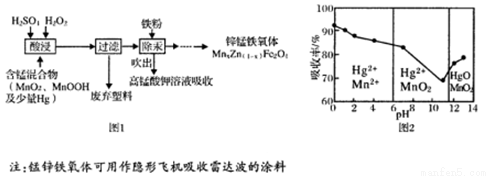
请回答下列问题:
(1)MnOOH中,锰元素的化合价为____。
(2)碱性锌锰干电池的电解质为KOH,Mn02参与的电板反应方程式为 。
(3)酸浸时,MnO2 与H2SO4、H2O2反应的离子方程式为 。
(4)在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图2所示:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。
(5)锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O
①当1molMnO2参加反应时,共有_____mol电子发生转移。
②MnOOH与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:_________________。
③已知:Ksp(MnCO3)=2.3×10-11、Ksp(Mn(OH)2))=2.1×10-13,欲制备MnCO3,选用的加料方式是______(填字母),原因是___________________________________。
a.将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d.以上三种方法都无法制得MnCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省肥城市高三二模理综化学试卷(解析版) 题型:选择题
下列说法正确的是

A.用如图装置除去乙烷中混有的乙烯
B.配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏大
C.制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中
D.玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省张掖市高三4月诊断考试理综化学试卷(解析版) 题型:简答题
【化学——选修2:化学与技术】(15分)将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO3-并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
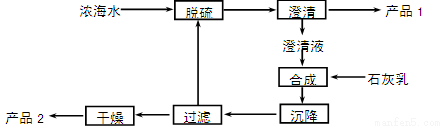
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_______,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1 L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省张掖市高三4月诊断考试理综化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.四氯化碳分子比例模型:
B.COS的电子式是
C.次氯酸的结构式为H-Cl-O
D.818O2-离子结构示意图:
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二下学期期中考试化学试卷(解析版) 题型:选择题
最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),其分子结构式为如图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的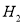 或NaOH的最大量分别是
或NaOH的最大量分别是
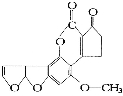
A.6mol;1mol B.5mol;1mol
C.6mol;2mol D.5mol;2mol
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高二4月月考化学试卷(解析版) 题型:填空题
(10分)(1)经元素分析后,发现某烃的含碳量为82.76%,氢的质量分数则为17.24%,且相对分子质量为58,该烃的分子式 。
(2)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重7.2g,氢氧化钠溶液增重30.8g。推测它的分子式 和结构简式 。
(3)某含氧有机物,它的相对分子质量为46.O,碳的质量分数为52.2%,氢的质量分数为33.0%,NMR中只有一个信号,请写出其结构简式 。
(4)某有机化合物仅由碳、氢、氧三种元素组成 ,经测定其相对分子质量为90 。称取该有机物样品1.8 g ,在足量纯氧中完全燃烧 ,将产物先后通过浓硫酸和碱石灰 ,两者分别增重1.08 g和2.64 g 。该有机物的分子式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省德阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
对于反应2SO2+O2 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A.2体积2SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向左移动
C.平衡时,SO2消耗速率必定等于O2生成速率的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com