
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
分析 A、求出硝酸铵的物质的量,然后根据1mol硝酸铵中含2molN原子来分析;
B、锌和浓硫酸的反应方程式为:Zn+2H2SO4=ZnSO4+SO2+H2O,和稀硫酸的反应为:Zn+H2SO4=ZnSO4+H2↑;
C、A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系:A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,且D为强电解质,中学常见物质中N、S元素单质化合物符合转化关系,Na元素单质化合物符合转化关系;
D、磁铁矿中铁元素以Fe3O4的形式存在.
解答 解:A、溶液中硝酸铵的物质的量n=CV=0.1mol/L×1L=0.1mol,而1mol硝酸铵中含2molN原子,故0.1mol硝酸铵中含0.2NA个氮原子,故A正确;
B、锌和浓硫酸的反应方程式为:Zn+2H2SO4=ZnSO4+SO2+H2O,若1mol浓硫酸和锌均按此反应进行,则1mol浓硫酸反应完全时,转移1mol电子;而锌和稀硫酸的反应为:Zn+H2SO4=ZnSO4+H2↑,若1mol浓硫酸均按此反应和锌反应,则1mol浓硫酸反应后转移2mol电子;而现在是锌先和浓硫酸反应,硫酸变稀后,锌和稀硫酸反应,故当1mol浓硫酸反应完全后,转移的电子数介于NA到2NA之间,故B错误;
C、若A是共价化合物,A可能为NH3或H2S,O.1mol的NH3分子中含有的电子数为NA,故C正确;
D、磁铁矿中铁元素以Fe3O4的形式存在,铁元素的价态为+$\frac{8}{3}$价,故当生成9mol铁时,转移$\frac{8}{3}×9$mol=24mol电子,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将卤代烃加入到热NaOH溶液中一段时间后,取上层液体,加入AgNO3液产生沉淀 | 证明卤代烃中含有卤元素 |
| B | 电石与水反应制得的气体直接通往酸性KMnO4溶液 | 证明制得的气体是否为乙炔 |
| C | 淀粉在硫酸催化作用下水解,将新制氢氧化铜悬浊液加入到水解后的溶液中 | 检验淀粉水解的产物葡萄糖 |
| D | 向纯碱中滴加醋酸,将产生的气体先通入饱和碳酸氢钠溶液再通入苯酚钠浓溶液 | 证明酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| B. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ | |
| D. | FeSO4溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| B. | 足量的Fe在Cl2中燃烧生成FeCl2和FeCl3 | |
| C. | 先后将等物质的量的Fe2O3和Fe分别溶于同一稀盐酸时无气体放出 | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3,在给定的条件下能实现转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
(1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| 平均值 | |||||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
 ;
; .
. ,反应类型为酯化反应或取代反应.
,反应类型为酯化反应或取代反应.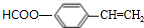 、
、 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
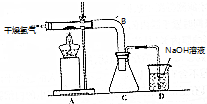 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由高到低:CI4>CBr4>CCl4>CF4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com