
【题目】祖母绿的主要成分为Be3Al2Si6Ol8,含有O、Si、Al、Be等元素。请回答下列问题:
(1)基态A1原子中,电子占据的最高能级的符号是_______________________,该能级具有的原子轨道数为_______。
(2)在1000℃时,氯化铍以BeCl2形式存在,其中Be原子的杂化方式为_________;在500600℃气相中,氯化铍则以二聚体Be2Cl4的形式存在,画出Be2Cl4的结构____________,1molBe2Cl4中含有____mol配位键。
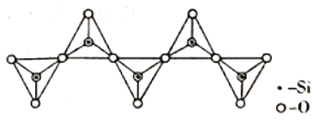
(3)氢化铝锂(LiAlH4)是有机合成中一种重要的还原剂,LiAlH4的阴离子的空间构型为____________,该阴离子的等电子体为____________(写一种分子、一种离子)。一种无限长单链结构的多硅酸根的一部分如图所示,则该硅酸根的化学式为____________________。
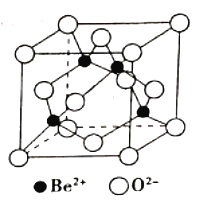
(4)用氧化物的形式表示出祖母绿的组成:___________。如图是Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度为ρg/cm3,则晶胞边长为__________cm。(设NA为阿伏加德罗常数的值,用含ρ、NA的代数式表示),O2-的配位数为_____________。
【答案】3p 3 p杂化 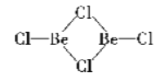 2 正四面体 SiH4(或CH4)、BH4 SiO32- 3BeO·Al2O3·6SiO2
2 正四面体 SiH4(或CH4)、BH4 SiO32- 3BeO·Al2O3·6SiO2 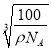 4
4
【解析】
(1)根据构造原理,书写出Al的核外电子排布式,就可确定电子占据的最高能级的符号及其具有的轨道数目。
(2)Be原子的价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断Be原子杂化方式;二聚体Be2Cl4中每个Be的价层电子对个数是3且不含孤电子对,得出它的结构;每个Be2Cl4中每个Be原子含有1个配位键;
(3) LiAlH4的阴离子为AlH4-,先算出其价电子对数,确定是否有孤电子对,得到空间构型;等电子体是指原子总数相等,价电子总数相等的微粒,AlH4-的原子数为5,价电子数为8;根据图示的一个单链结构的多硅酸根,可得到化学式;
(4)根据硅酸盐用氧化物的形式表示时书写顺序:活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水;用均摊方法计算晶胞中各种元素的原子个数,可得原子个数比和化学式,结合密度与物质质量关系确定晶胞参数,根据微粒相对位置确定O2-的配位数。
(1)Al是13号元素,根据构造原理,可知基态Al原子核外电子排布式为1s22s22p63s23p1,能级最高的是3p能级,p能级有3个轨道,分别为px、py、pz轨道;
(2)在BeCl2分子中,Be的价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断Be原子杂化方式为sp;二聚体Be2Cl4中每个Be的价层电子对个数是3且不含孤电子对,得出它的结构为: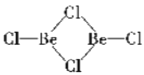 ;每个Be2Cl4中每个Be原子含有1个配位键,则每个 Be2Cl4中含有2个配位键,所以1mol Be2Cl4中含有2mol配位键;
;每个Be2Cl4中每个Be原子含有1个配位键,则每个 Be2Cl4中含有2个配位键,所以1mol Be2Cl4中含有2mol配位键;
(3)LiAlH4的阴离子为AlH4-,算出其价电子对数=4+![]() =4,无孤电子对,因此离子的空间构型为正四面体形;等电子体是指原子总数相等,价电子总数相等的微粒,AlH4-的原子数为5,价电子数为8,故与其互为等电子体的为CH4、NH4+;根据图示的一个结构单元中含有1个硅、2+2×
=4,无孤电子对,因此离子的空间构型为正四面体形;等电子体是指原子总数相等,价电子总数相等的微粒,AlH4-的原子数为5,价电子数为8,故与其互为等电子体的为CH4、NH4+;根据图示的一个结构单元中含有1个硅、2+2×![]() =3个氧原子,则Si与O的原子数之比为1:3,化学式为SiO32-;
=3个氧原子,则Si与O的原子数之比为1:3,化学式为SiO32-;
(4)祖母绿的主要成分为Be3Al2Si6O18,用氧化物的形式表示时书写顺序是:活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水,所以Be3Al2Si6O18可以表示为:3BeOAl2O36SiO2;该晶胞中含有O2-个数=8![]() =4、Be2+个数=4,晶胞质量m=
=4、Be2+个数=4,晶胞质量m=![]() =
=![]() g,氧化铍的密度为ρg/cm3,则晶胞体积V=
g,氧化铍的密度为ρg/cm3,则晶胞体积V=![]() ,所以晶胞参数a=
,所以晶胞参数a=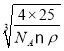 cm=
cm=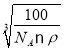 ,根据图示可知,O2-面心和顶点,由图看出距离最近的Be原子上下各2个,共四个,所以配位数为4。
,根据图示可知,O2-面心和顶点,由图看出距离最近的Be原子上下各2个,共四个,所以配位数为4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和HCl的物质的量之比为________。写出化学方程式并用双线桥法标出电子转移_______________________________________________。
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O
若生成2 mol H3AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃,沸点在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。

(1)SO2Cl2中的S的化合价为_______________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为_______________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(部分夹持装置未画出)。
①仪器A的名称为_______________,装置乙中装入的试剂是_______________,装罝B的作用是_______________。
②装置丙分液漏斗中盛装的最佳试剂是_______________(选填编号)。
A.蒸馏水 B.l0.0mol·L-1浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL0.50000mol·L-1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L-1标准HC1滴定至终点,重复实验三次取平均值,消耗HCl l0.00mL。达到滴定终点的现象为_______________,产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
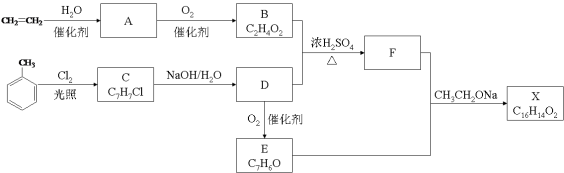
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1)E中官能团的名称是 。
(2)B+D→F的化学方程式 。
(3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H7Cl的有机物,其结构不可能是( )
A. 分子中只有一个双键
B. 分子中可能有两个双键
C. 分子中可能含有一个叁键
D. 分子中可能含有一个双键和一个环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成份。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展的重要标志)

(1)A分子的空间构型是_______。
(2)D的化学式是_______________,F中含氧官能团的名称是______________。
(3)②的化学方程式是___________,⑤的反应类型是_________
(4)1mol乳酸与足量NaOH反应,消耗NaOH__________mol。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符号绿色化学要求的是__________(填序号)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl c.2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
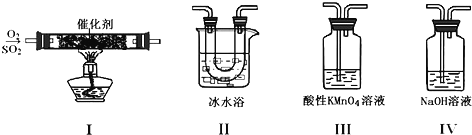
【题目】利用如图所示的装置研究SO2的性质:
已知:
物质 | 熔点℃ | 沸点℃ |
SO2 | -76.1 | -10 |
SO3 | 16.8 | 45 |
(1)装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式________________。
(2)甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是___;观察到装置Ⅲ中现象是________________,说明二氧化硫具有___性
(3)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40mL2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的总的化学方程式是___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用如图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
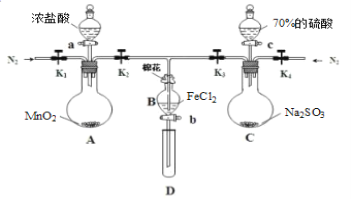
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________。
(2)棉花中浸润的溶液为________________,作用是____________ 。
(3)导致步骤Ⅲ中溶液变黄的离子反应是__________,用________(写试剂化学式)检验氧化产物,现象是____________。
(4)能说明氧化性Fe3+>SO2的离子方程式是___________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有 |
乙 | 既有Fe3+又有Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子立体构型为正四面体形,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列判断正确的是
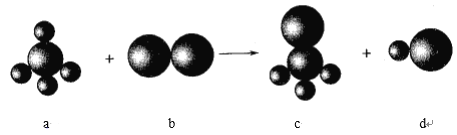
A. 四种分子中的化学键均是极性键
B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键
D. b、d分子中共价键的键能:b>d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com