
【题目】下列各组离子在溶液能够大量共存的是 ( )
A. Ca2+、Cl-、K+、CO32- B. Fe3+、Cl-、H+、SO42-
C. Fe2+、OH-、NO3-、SO42- D. Mg2+ 、Na+、OH-、K+
科目:高中化学 来源: 题型:
【题目】如图是500 ℃时, 1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图。若在温度恒定,体积不变的容器中反应达到平衡,再充入NO2则,ΔH________(填“增大”、“减小”或“不变”,下同)。请写出NO2和CO反应的热化学方程式:__________。该反应能自发进行的主要原因为_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、D、C、A、E五种元素的原子序数顺序依次增大,其中只有E为金属元素,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
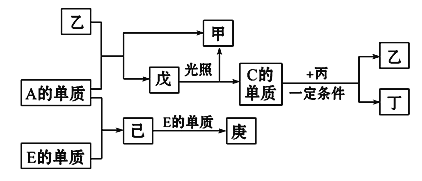
请回答下列问题:
(1)写出E的原子结构示意图_________________________。
(2)写出C、D氢化物的稳定性由强到弱的顺序____________。(用化学式表示)。
(3)A、B、D三种元素形成的化合物中,含有化学键的类型为___________。
(4)写出C与丙反应的化学反应方程式_________________________________。
(5)写出工业上从海水中制取A的离子反应方程式____________________________。
(6)工业上通过如下转化可制得含A元素的钾盐KAO3晶体:

①完成Ⅰ中反应的总化学方程式: ________
NaA+ H2O![]() NaAO3+
NaAO3+
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH4+):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol.若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示).若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是_______(填“正向移动”、“逆向移动”或“不移动”)。
CH3OH(g) ΔH=-128.8 kJ/mol.若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示).若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是_______(填“正向移动”、“逆向移动”或“不移动”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡时数据 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
体系压强(Pa) | p1 | p2 | p3 | |
则a+b=________;a1+a3________1(填“<”、“>”或“=”,下同);2p2________p3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述不正确的是( )
A.将少量二氧化硫添加到红酒中可起到杀菌和抗氧化作用
B.甘油、生物柴油和汽油都属于烃类物质
C.中国天眼FAST用到的碳化硅是一种无机非金属材料
D.用CO2合成聚碳酸酯可降解塑料可实现碳的循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100 mL-1)。
Ⅰ.实验步骤:
(1)配制待测白醋溶液。用________________(填仪器名称)量取10.00 mL食用白醋,在__________(填仪器名称)中用水稀释后转移到100 mL__________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
(3)读取盛装0.100 0 mol·L-1NaOH 溶液的碱式滴定管的初始读数。
(4)滴定。判断滴定终点的现象是:_________________,到达滴定终点,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
(5)如图是某次滴定时的滴定管中的液面,其读数为________mL。
![]()
Ⅱ.实验记录
实验数据(mL) 滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V= mL=15.24 mL。指出他计算的不合理之处:______。按正确数据处理,得c(市售白醋)=_____mol·L-1;市售白醋总酸量=_____g·100 mL-1。
mL=15.24 mL。指出他计算的不合理之处:______。按正确数据处理,得c(市售白醋)=_____mol·L-1;市售白醋总酸量=_____g·100 mL-1。
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生复分解反应,需查找在一定温度下的________(填序号)。
A.pH B.电离度 C.电离平衡常数 D.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是_________(填写序号)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com