
| A. | CH2=CH-CH=CH2 1,3-丁二烯 | B. |  3-丁醇 3-丁醇 | ||
| C. |  甲基苯酚 甲基苯酚 | D. |  2-乙基丙烷 2-乙基丙烷 |
分析 A.CH2=CH-CH=CH2 分子中在1、3碳上有双键,属于二烯烃;
B. 在距离-OH最近的一端开始编号,-OH在2号C;
在距离-OH最近的一端开始编号,-OH在2号C;
C.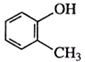 甲基苯酚,没有指出甲基的位置;
甲基苯酚,没有指出甲基的位置;
D.烷烃命名时2号C上不能有乙基.
解答 解:A.CH2=CH-CH=CH2 分子中在1、3碳上有双键,属于二烯烃,命名为:1,3-丁二烯,故A正确;
B. 在距离-OH最近的一端开始编号,-OH在2号C,该有机物命名为:2-丁醇,故B错误;
在距离-OH最近的一端开始编号,-OH在2号C,该有机物命名为:2-丁醇,故B错误;
C. 甲基苯酚,没有指出甲基的位置,正确命名为:邻甲基苯酚,故C错误;
甲基苯酚,没有指出甲基的位置,正确命名为:邻甲基苯酚,故C错误;
D. ,烷烃命名时2号C上不能有乙基,该烷烃主链4个C,2号C上有甲基,则正确命名为:2-甲基丁烷,故D错误;
,烷烃命名时2号C上不能有乙基,该烷烃主链4个C,2号C上有甲基,则正确命名为:2-甲基丁烷,故D错误;
故选A.
点评 本题考查了有机物的系统命名法,题目难度不大,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:| 化学键 | H-H | O-H | C-H |  |
| E/(kJ•mol-1) | 436 | 465 | 413 | 1076 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A. | 液氧 | 漂白粉 | Al2O3 | CO |
| B. | 生理盐水 | 氢氧化铁胶体 | Na2O2 | 乙醇 |
| C. | 碱石灰 | 盐酸 | K2O | Cl2 |
| D. | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | .A | B. | .B | C. | .C | D. | .D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质均是天然高分子化合物 | |
| B. | 电解熔融MgCl2,可制得金属Mg | |
| C. | 盐类都可用做调味品 | |
| D. | 医用酒精的浓度是100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸溶液中加入氯化钡溶液 | |
| B. | 向硫酸溶液中加入氢氧化钡溶液 | |
| C. | 向氯化钡和氢氧化钠的混合溶液中加入足量硫酸溶液 | |
| D. | 向氢氧化钡溶液加入少量硫酸和盐酸的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题


| A. | ①②③④ | B. | ②③④ | C. | 只有② | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 mol•L-1 | B. | 10 mol•L-1 | C. | 8 mol•L-1 | D. | 6.7 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com