
| V |
| Vm |
. |
| M |
| m总 |
| n总 |
| 11.2L |
| 22.4L/mol |
| 15g |
| 0.5mol |
|
| 7 |
| 16 |
| 1 |
| 16 |
| 7 |
| 16 |
| 1 |
| 16 |


科目:高中化学 来源: 题型:
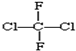 和
和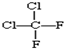 ; ⑨
; ⑨ 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取100mL5mol/LH2SO4,加入400mL水 |
| B、取200mL5mol/LHCl,加水稀释至500mL |
| C、取100 mL5mol/LH2SO4,加水500mL |
| D、取100 mL5mol/LHNO3,加水稀释至500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10.8 g X2O5中含有0.5 mol O,则X的相对原子质量为28 |
| B、4 g某气体含有的分子数为3.01×1023,则2 g该气体在标准状况下的体积是5.6 L |
| C、同温同压下,10 L X2气体跟30 L Y2气体化合生成20 L某Z气体,则Z的化学式为XY2 |
| D、标准状况下,相同质量的N2、O2、Cl2中,体积最大的是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿伏加德罗常数是一个纯数,没有单位 |
| B、常用NA表示阿伏加德罗常数 |
| C、阿伏加德罗常数是一个实验值 |
| D、阿伏加德罗常数常用:6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com