
【题目】钠与水反应的离子方程式正确的是( )
A.2Na+3H+═2Na++H2↑
B.Na+H2O═Na++OH﹣+H2↑
C.2Na+2H2O═2Na++2OH﹣+H2↑
D.2Na+2H2O═2Na++O2↑+2H2↑
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下能发生银镜反应,不能发生水解反应的是( )
①甲酸甲酯 ②乙酸乙酯 ③葡萄糖 ④果糖
A. ①④ B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂。已知K2FeO4在Fe3+和Fe(OH)3催化下会分解,在酸性或弱碱性能与水反应生成Fe(OH)3和O2。生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O
(1)该反应中氧化剂是______________(写电子式)
(2)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_____________________(回答一条即可)。
(3)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是__________________________________________。
②原样品中高铁酸钾的质量分数为______________。
II、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/moL ①
C(s)+O2(g)=CO2(g) △H=–393.5kJ/moL ②
2C(s)+O2(g)=2CO(g) △H=–221.0kJ/moL ③
(4)某反应的平衡常数表达式![]() ,请写出此反应的热化学方程式:__。
,请写出此反应的热化学方程式:__。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是___________(填序号)
a.容器中的压强不变
b.2v正(CO)= v逆(N2)
c.气体的平均相对分子质量保持34.2不变
d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO3(g) ![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
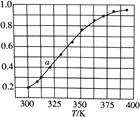
图中a点对应温度下,已知SO3的起始压强为P0kPa,该温度下反应的平衡常数KP=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中按![]() =1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
=1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As、Ga、Cr、Cu等元素化合物种类繁多,具有重要的研究价值和应用价值。请回答下列问题:
(1)Cr元素价电子排布式为__________________。
(2)N2F2分子中,氮原子的杂化轨道类型为_______,画出N2F2可能的结构式_____。
(3)PCl3和PCl5是磷元素形成的两种重要化合物,请根据价电子互斥理论推测PCl3的空间构型__________________。
(4)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构,性能比硅更优良。广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中。
①砷化镓属于____晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是___(填化学式),其理由是____。上述两种晶体中的四种元素电负性最小的是_____(填元素符号)。
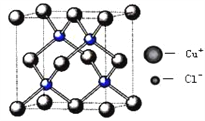
(5)铜的化合物种类很多,下图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氢化亚铜密度的计算式为ρ=_______g/cm3.(用NA表示阿佛加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂B.作氧化剂
C.既作氧化剂又作还原剂D.既不作氧化剂又不作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
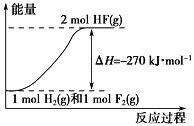
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
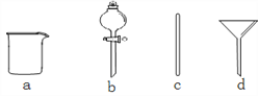
【题目】Ⅰ.实验室需要配制0.1 mol·L-1NaOH溶液500mL。
(1)根据计算用托盘天平称取的质量为__________g。在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)下面操作造成所配NaOH溶液浓度偏高的是_____。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
II.向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再向所得溶液中滴加0.1 mol/L盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
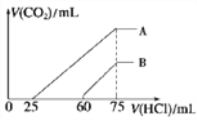
(4)①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是________mL(标准状况)。
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
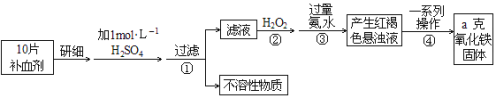
请回答下列问题:
(1)步骤②加入过量H2O2的目的:________________________________________;
(2)步骤③中反应的离子方程式:________________________________________;
(3)步骤④中一系列处理的操作步骤:________、洗涤、______、冷却、称量。
(4)实验中用浓硫酸配制1 mol/L的稀硫酸,配制时用到的定量玻璃仪器有________、__________。
(5)若实验无损耗,则每片补血剂含铁元素的质量___________g(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com