解:(1)普钙的有效成分是磷酸二氢钙,其化学式为:Ca(H
2PO
4)
2,Ca(H
2PO
4)
2;
(2)氨气和二氧化碳在加压、加热条件下反应生成氨基甲酸铵,氨基甲酸铵脱水生成尿素和水,其反应方程式为:2NH
3+CO
2
H
2NCOONH
4,H
2NCOONH
4=H
2NCONH
2+H
2O,
故答案为:2NH
3+CO
2
H
2NCOONH
4,H
2NCOONH
4=H
2NCONH
2+H
2O;
(3)根据氮原子守恒可知,
NH
3~NO~HNO
3,
则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,
由HNO
3+NH
3═NH
4NO
3,
则该反应消耗的氨气的物质的量为0.8832mol,
氨气的质量之比等于物质的量之比,
则制HNO
3所用去的NH
3的质量占总耗NH
3质量的百分数=
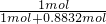
×100%=53.1%,
故答案为:53.1;
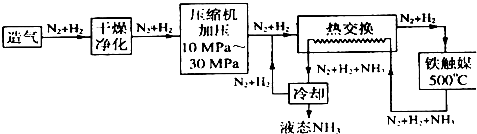
(4)从反应特点来说,许多化学反应是可逆反应,转化率低;从能源利用及经济方法来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺流程来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;在500℃时催化剂的活性最大,
故答案为:从反应特点来说,许多化学反应是可逆反应,转化率低;从能源利用及经济方法来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺流程来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;在500℃时催化剂的活性最大.
分析:(1)普钙的有效成分是磷酸二氢钙;
(2)氨气和二氧化碳在加压、加热条件下反应生成氨基甲酸铵,氨基甲酸铵脱水生成尿素和水;
(3)据NH
3制NO的产率是96%、NO制HNO
3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO
3跟NH
3反应生成NH
4NO
3来计算氨气的量,最后计算制HNO
3所用去的NH
3的质量占总耗NH
3质量的百分数;
(4)从反应特点、能源利用和经济方面、工艺流程、环保角度进行分析,催化剂在一定温度范围内活性最高.
点评:本题考查化学反应方程式的书写、化工生产等知识点,注意(3)中原子守恒的运用,难度不大.

 H2NCOONH4,H2NCOONH4=H2NCONH2+H2O,
H2NCOONH4,H2NCOONH4=H2NCONH2+H2O, H2NCOONH4,H2NCOONH4=H2NCONH2+H2O;
H2NCOONH4,H2NCOONH4=H2NCONH2+H2O;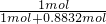 ×100%=53.1%,
×100%=53.1%,




