


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| A、单位时间生成nmol的C,同时生成2nmol 的AB |
| B、容器内的总压,不随时间变化 |
| C、容器内气体密度不变 |
| D、单位时间生成n mol的A2,同时生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
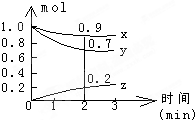 某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO8- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
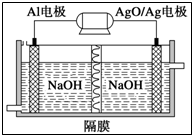 (1)现有以下物质:
(1)现有以下物质:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
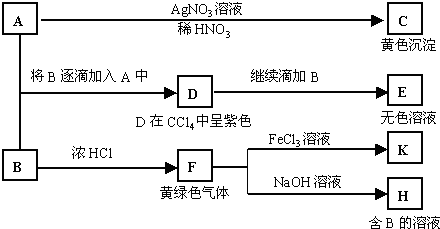
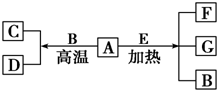 A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体.
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、苹果酸在一定条件下能发生加成反应 |
| D、1 mol苹果酸与Na2CO3溶液反应最多生成2 mol CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com