
| A.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ |
| B.c(Fe2+)︰c(Cu2+) = 2︰1 |
| C.c(Fe2+)︰c(Fe 3+) = 3︰1 |
| D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L |
科目:高中化学 来源:不详 题型:单选题
| A.Fe3O4是—种红棕色粉末,俗称磁性氧化铁 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.去除FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 |
| D.Fe3+与KSCN反应产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
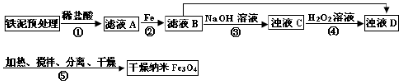
|
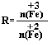 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。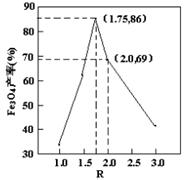
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
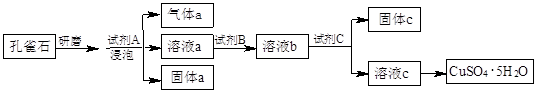
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.仅用KSCN可以检验Fe2+ | B.可以用NaOH溶液检验Fe3+ |
| C.通过化合反应可以得到Fe(OH)3 | D.通过化合反应可以得到FeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
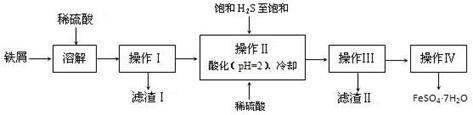
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
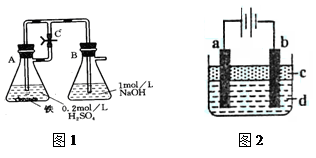
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色 Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
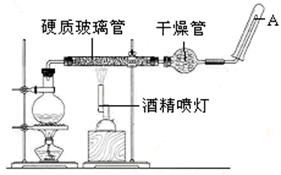
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 过程 | 思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般 物质有还原性, 物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是 (用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 | …… |
| …… | …… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com