

【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
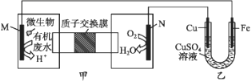
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-![]() 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+
C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
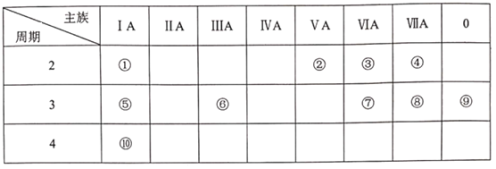
(1)⑧的单质是有毒气体, 它能与强碱稀溶液反应,其离子方程式为_________,③和⑤构成的具有漂白性的化合物,其电子式为______________。
(2)表中能形成两性氧化物的元素是____, 写出该元素的单质与⑩的最高价氧化物的水化物反应的离子方程式__________。
(3)④⑤⑦⑩四种元素简单离子半径由大到小的顺序是_____________。
(4)上述元素的最高价氧化物对应的水化物酸性最强的是______(填写化学式), 非金属气态氢化物还原性最强的是_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
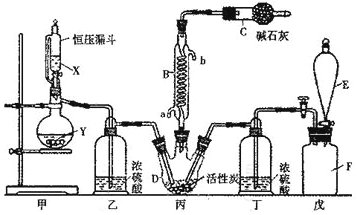
(1)仪器E的名称是_______,由B的使用可知SO2与氯气之间的反应居于______(填“放”或“吸”)热反应,B处反应管冷却水应从___________(填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是__________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为__________%(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的说法正确的是
A.甲醇在铜催化和加热条件下生成的产物不存在同分异构体
B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热,得到三种烯烃。
C.有机物![]() 的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。
的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。
D.分子式为C5H10O2的有机物中含有![]() 结构的同分异构体有12种
结构的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如图:
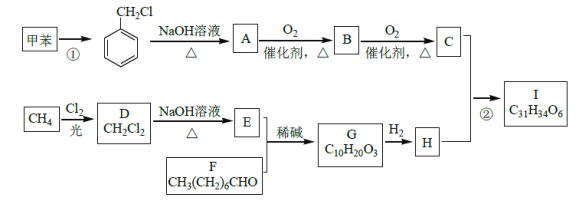
已知:a.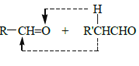
![]()
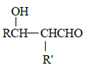
b.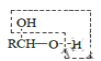
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是___;F的化学名称为___。
(2)②的反应类型是___;A→B的化学方程式为____。
(3)G的结构简式为____;H中所含官能团的名称是___。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W的结构简式___。
①遇FeCl3溶液显紫色②属于芳香族化合物③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备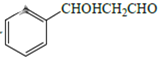 的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从小白菊中提取的一种有机物。下列关于该有机物的说法正确的是
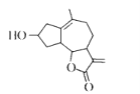
A.可在酸件或碱性溶液中稳定存在
B.其同分异构体存在芳香族化合物
C.能使溴水或酸性KMnO4溶液褪色,其原理相同
D.分子中所有原子一定在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验存在不合理的装置是
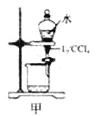
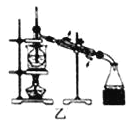
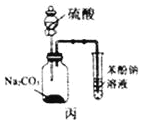

A.装置甲:用CCl4萃取碘水中的碘
B.装置乙:加热碘的CCl4溶液,分离碘并回收CCl4
C.装置丙:验证硫酸、碳酸、苯酚溶液的酸性
D.用乙酸、乙醇制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为__________.
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和______(填化学式)。
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。
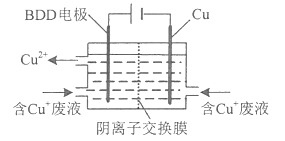
第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:________(填离子方程式) .
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式) 。
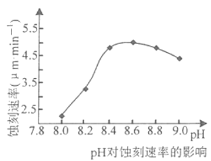
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com