
分析 .9g R与足量酸反应生成0.1g氢气,则R失去电子与H得到电子相同,$\frac{0.9g}{M}$×n=$\frac{0.1g}{2g/mol}$×2×(1-0),讨论n、M确定元素,然后书写化学反应方程式.
解答 解:设金属的摩尔质量为M,它与足量酸反应生成Rn+,反应后R元素的化合价为+n,
R失去电子与H得到电子相同,$\frac{0.9g}{M}$×n=$\frac{0.1g}{2g/mol}$×2×(1-0),即M=9n,
R为核电荷数在1~18间的金属元素,n=1,M=9,不符合;
n=2,M=18,不符合;
n=3,M=27,为金属Al,
则反应方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑,
答:R与稀硫酸反应的化学方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑,R的化合价为+3价,相对原子质量为27.
点评 本题考查化学反应方程式及物质的量的计算,为高频考点,把握金属与酸反应中电子守恒为解答的关键,侧重分析与计算能力的考查,注意讨论法的应用,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 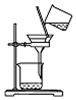 用图所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 | |
| B. |  用图所示装置蒸发掉CuCl2溶液中大部分水制得CuCl2•2H2O晶体 | |
| C. | 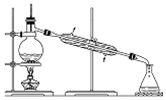 用图所示装置从乙酸和乙酸乙酯的混合液中分离得到纯净的乙酸乙酯 | |
| D. | 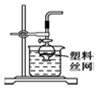 用图所示装置,用块状大理石与稀盐酸反应制取CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol/LAg+ | B. | 0.4mol/L Ba2+ | C. | 0.4mol/L Mg2+ | D. | 0.2mol/L CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 铝粉投入到 NaOH 溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 铁粉与稀硫酸溶液反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Cl2 与烧碱溶液跟反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| B. | 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA | |
| C. | 常温常压下,32gO2和32g O3所含氧原子数分别是2NA和3NA | |
| D. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com