
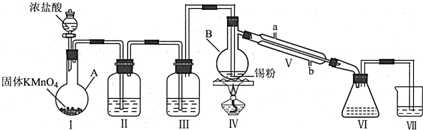
分析 由装置图可知装置Ⅰ应为制备氯气装置,涉及化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,装置Ⅱ为饱和食盐水,装置Ⅲ为浓硫酸,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4,经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中,
(1)认识常见的化学实验仪器
(2)装置Ⅱ为饱和食盐水,装置Ⅲ为浓硫酸,氯气经除杂,干燥后与锡在Ⅳ中反应生成SnCl4,因SnCl4极易水解,Ⅶ可起到防止空气中的水蒸气进入Ⅵ中;
(3)A.为防止液体暴沸,应加碎瓷片,故A正确;
B.为了控制温度,仪器B中可以使用温度计,应用油浴加热,故B错误;
C.装置Ⅴ不可以用球形或蛇形冷凝管代替,因SnCl4容易聚在管内不流下,故C错误;
D.装置Ⅴ中b为冷凝水的进水口,故D错误.
(4)装置Ⅰ中浓盐酸与KMnO4发生反应产生氯气;
(5)若没有III,则SnCl4会水解产生Sn(OH)4等物质;
(6)Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,11.9gSn即0.1mol完全反应可生成SnCl426.1g,故产率为23.49/26.1×100%=90%
解答 解:由装置图可知装置Ⅰ应为制备氯气装置,涉及离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,装置Ⅱ为饱和食盐水,装置Ⅲ为浓硫酸,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4,经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中.
(1)仪器C的名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)由于盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在与金属锡反应前要除去,因此装置Ⅱ中的最佳试剂为除去HCl同时还可以减少氯气消耗的饱和食盐水;SnCl4极易水解,在潮湿的空气中发烟.为了防止盐水解,所以要防止起水解.装置Ⅶ的作用为防止空气中的水蒸气进入Ⅵ中使SnCl4水解,
故答案为:饱和氯化钠溶液;干燥Cl2;
(3)A.为防止液体暴沸,应加碎瓷片,故A正确;
B.为了控制温度,仪器B中可以使用温度计,应用油浴加热,故B错误;
C.装置Ⅴ不可以用球形或蛇形冷凝管代替,因SnCl4容易聚在管内不流下,故C错误;
D.装置Ⅴ中b为冷凝水的进水口,故D错误.
故选A;
(4)装置Ⅰ中浓盐酸与KMnO4发生反应产生氯气.发生化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(5)如果没有装置Ⅲ,则在氯气中含有水蒸汽,所以在Ⅳ中除生成SnCl4外,还会生成SnCl4水解产生的含锡的化合物H2SnO3或SnO2或Sn(OH)4或H4SnO4,应防止空气中的水蒸气进入装置Ⅵ中,用一个盛有碱石灰的球形干燥管代替装置Ⅶ,
故答案为:H2SnO3或SnO2或Sn(OH)4或H4SnO4;碱石灰;
(6)若Ⅳ中用去锡粉11.9g,则n(Sn)=0.1mol,理论上产生的SnCl4的物质的质量是m(SnCl4)=0.1mol×261g/mol=26.1g所以反应后,若Ⅵ中锥形瓶里收集到23.49gSnCl4,则SnCl4的产率为$\frac{23.49}{26.1}$×100%=90%,故答案为:90%.
点评 本题考查物质的制备,涉及仪器的识别、氯气的实验室制取方法、实验操作的目的、盐的水解、物质产率的计算等知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
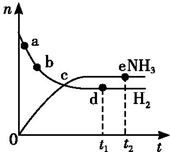 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相等 | |
| B. | c点和e点H2的转化率相等 | |
| C. | 平衡后再升高温度,不利于氨的合成 | |
| D. | d点时:n(H2):n(NH3)=3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
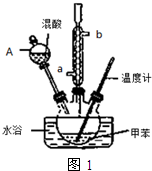 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.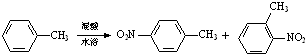
| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 1 mol | ||
| C. | >1 mol | D. | 0.6 mol<n(CO2)<1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com