
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 物质燃烧反应都是放热反应 | |
| C. | 酸碱中和反应可能是吸热反应 | |
| D. | 放热反应不要加热就能发生反应 |
分析 A、吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B、燃烧反应都是放热反应;
C、酸碱中和反应都是放热反应;
D、一个化学反应发生的条件与反应的热效应无关.
解答 解:A、需要加热才能发生的反应不一定是吸热反应,如铝热反应需要在高温下发生,但是放热反应,故A错误;
B、燃烧反应都是放热反应,故B正确;
C、酸碱中和反应都是放热反应,故C错误;
D、放热的反应在常温下不一定很容易发生,如:铝热反应2 Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,故D错误;
故选B.
点评 该题考查了化学反应的条件与化学反应的热效应间的关系已经常见的放热反应,需正确理解放热吸热的本质,是解题的关键.


科目:高中化学 来源: 题型:解答题
 某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.
某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 金属 | 酸溶液的浓度和体积 | 温度/℃ |
| A | 2.4 g 锌片 | 3 mol•L -1硫酸50 mL | 40 |
| B | 2.4 g锌粉 | 1 mol•L-1硫酸200 mL | 30 |
| C | 2.4 g锌粉 | 3 mol•L-1硫酸50 mL | 40 |
| D | 5.6 g锌片 | 3 mol•L-1硫酸1 00 mL | 30 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
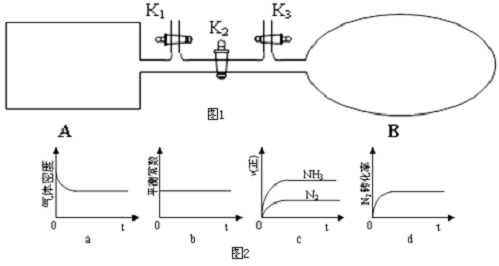
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 298 | 块状 | 2.00 |
| ② | |||
| ③ | 308 | 块状 | 2.00 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5×10-7 mol/L | B. | 1×10-7 mol/L | C. | 2×10-7 mol/L | D. | 4×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者均可作为水果催熟剂 | |
| B. | 二者均可使酸性高锰酸钾溶液褪色 | |
| C. | 常温常压下二者均为难溶于水的气体 | |
| D. | 在一定条件下二者均能与氢气发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com