
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )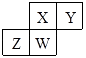
A.原子半径:Z>W>X>Y
B.元素X、Y、Z、W的最高化合价分别与其主族序数相等
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.最高价氧化物对应水化物的酸性:X>W>Z
【答案】B
【解析】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,结合元素周期表结构可知,X、Y应该位于第二周期、Z、W位于第三周期;W原子的质子数是其最外层电子数的三倍,设W的最外层电子数为x,则3x=2+8+x,解得:x=5,W为P元素,则Z为Si元素、X为N元素、Y为O元素,
A.X、Y含有两个电子层,核电荷数Y大于X,则原子半径X>Y;Z、W含有3个电子层,核电荷数W的解答,其原子半径较小,则原子半径大小为:Z>W>X>Y,故A不符合题意;
B.Y为氧元素,氧元素没有最高正价,故B符合题意;
C.最简单气态氢化物的热稳定性取决于非金属性大小,非金属性:Y>X>W>Z,则其最简单氢化物稳定性大小为:Y>X>W>Z,故C不符合题意;
D.再根据氧化物对应水合物的酸性与非金属性大小有关,非金属性X>W>Z,则再根据含氧酸的酸性大小为:X>W>Z,故D不符合题意;
故答案为:B.
根据短周期元素X、Y、Z、W在元素周期表中的相对位置,结合元素周期表结构可知,判断出X、Y应该位于第二周期、Z、W位于第三周期;W原子的质子数是其最外层电子数的三倍,设W的最外层电子数为x,则3x=2+8+x,解得:x=5,W为P元素,则Z为Si元素、X为N元素、Y为O元素,结合元素周期律知识解答即可.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 等质量的甲烷和乙烯完全燃烧,甲烷消耗的O2多
B. C5H11Cl有6种同分异构体
C. 聚乙烯与乙烯性质相似,可使溴水褪色
D. 正丁烷和异丁烷互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是( )
A.硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏
B.单质分子中均含共价键
C.HF与HBr相比,分子内共价键更强,所以HF沸点更高
D.由不同元素组成的多原子分子里,只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.乙烯能与溴的四氯化碳溶液反应使溶液逐渐褪色
B.乙醛能与新制氢氧化铜反应产生砖红色沉淀
C.糖类物质都能发生水解反应
D.在一定条件下,氨基酸之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(C11H12O2)属于芳香酯类物质,可由下列路线合成:
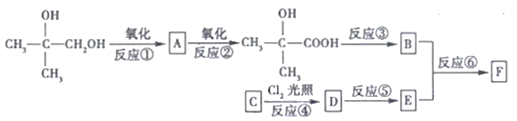
请回答下列问题:
(1)A中官能团的名称是__________,上述③④⑤⑥中属于取代反应的是_______________。
(2)C物质的名称是_______,反应③的条件是________________________。
(3)B在一定条件下可以形成高分子化合物,写出此过程的化学方程式:_________________。
(4)反应⑥的化学方程式为___________________________________。
(5)A、B、E三种有机物,可用下列的某一种试剂鉴别,该试剂是_______________________。
a.新制的Cu(OH)2悬浊液 b.溴水
c.酸性KMnO4溶液 d.溴的CC14溶液
(6)G是E的同系物且相对分子质量比E大28。G有多种同分异构体,其中符合下列条件的同分异构体有____种,其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式为_____________________。
①能与Na2CO3溶液反应 ②分子中含有两个一CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说法正确的是( )
A. 溴、碘单质和四氯化碳中都含有卤素
B. 溴、碘是单质,四氯化碳是化合物
C. Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D. 以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g)△H<0 完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率 mol(Lmin)﹣1;该反应的平衡常数表达式K= .
(2)上述反应达到平衡后,下列说法正确的是 .
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量,平衡向左移动
d.其他条件不变,增大HCl物质的量,平衡向左移动
(3)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com