
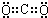 .
.分析 Ⅰ、气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2.根据标准状况下的体积可知其物质的量为;
X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,而题中给出Ⅰ中为溶液;
Ⅱ、X中一定不含Na,因为Na的焰色为黄色.
Ⅲ、根据题给信息知调节pH至5~6时生成的白色沉淀为Al(OH)3.
Ⅳ、加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O.
Ⅴ、加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2.以此可解答(1)(4)(5)(6)题;
(1)A为二氧化碳是碳原子分别和两个氧原子形成两对共用电子对形成的共价化合物;
(2)题目中盐酸的物质的量为:0.045L×2mol/L=0.09mol,二氧化碳的物质的量为:$\frac{112×1{0}^{-3}}{22.4mol/L}$=0.005mol,
Ⅰ中发生的反应为:H++OH-═H2O,CO32-+2H+═CO2↑+H2O,根据反应的量的关系可求的(2)题;
(3)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀;
(4)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式;
(5)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解;
(6)根据“Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全;
(7)Mg(OH)2 的物质的量为$\frac{1.74g}{58g/mol}$=0.03mol,根据X中n(B):n(C)=1:3,则Al(OH)3 的物质的量为0.01mol,
则n(CO2):n[Al(OH)3]:n[Mg(OH)2]=0.005:0.01:0.03=1:2:6,则CO32-、Al3+、Mg2+的物质的量之比为1:2:6,结合电荷守恒,
则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:6:16,根据相对分子质量为602,可知1molX中含有4molH2O,可解答(7)题中的化学式.
解答 解:(1)气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2,为共价化合物,电子式为: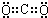 ,故答案为:
,故答案为: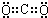 ;
;
(2)Ⅰ中发生的反应为:H++OH-═H2O,CO32-+2H+═CO2↑+H2O,盐酸的物质的量为:0.045L×2mol/L=0.09mol,二氧化碳的物质的量为:$\frac{112×1{0}^{-3}}{22.4mol/L}$=0.05mol,n(OH-)=0.09mol-0.005mol×2=0.08mol,所以:n(OH-):n(CO32-)=0.08mol:0.005mol=16:1,
故答案为:n(OH-):n(CO32-)=1.6:1.
(3)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,而题中给出Ⅰ中为溶液,
故答案为:Si;
(4)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式,离子方程式为:Al3++3NH3•H20═Al(OH)3+↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(6)根据“Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全,”加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2,
故答案为:Mg(OH)2;
(7)已知:Mg(OH)2 的物质的量为$\frac{1.74g}{58g/mol}$=0.03mol,根据X中n(B):n(C)=1:3,则Al(OH)3 的物质的量为0.01mol,
则n(CO2):n[Al(OH)3]:n[Mg(OH)2]=0.005:0.01:0.03=1:2:6,则CO32-、Al3+、Mg2+的物质的量之比为1:2:6,结合电荷守恒,
则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:6:16,根据相对分子质量为602,可知1molX中含有4molH2O,所以X的化学式为Al2Mg6(OH)16CO3•4H2O,
故答案为:Al2Mg6(OH)16CO3•4H2O.
点评 本题考查平达喜药物成分的探究实验,题目较为综合,本题易错点为第(7)题,根据质量守恒定律解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
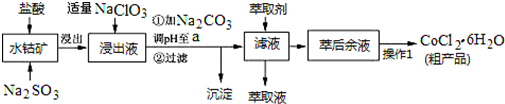
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
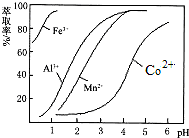
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应就是既能向正反应方向进行,又能向逆反应方向进行的化学反应 | |
| B. | 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应 | |
| C. | 对于合成氨的反应,如果调控好反应条件,可使一种反应物的转化率达到100% | |
| D. | 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这两个反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu、Fe | B. | K、Na | C. | Cu、Al | D. | Zn、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | MgCl2 | B. | NaF | C. | MgO | D. | K2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Br-、CO32-、OH- | B. | H+、Br-、ClO-、SO42-、Na+ | ||
| C. | SO42-、Br-、H+、Fe3+ | D. | Br-、SO32-、OH-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com