
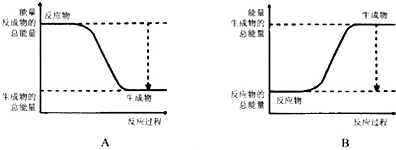
 根据化学反应与能量转化的相关知识,试回答下列问题:
根据化学反应与能量转化的相关知识,试回答下列问题:分析 (1)黑磷比白磷稳定,则黑磷能量较低,白磷转化为黑磷为放热反应;
(2)n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出890KJ的能量;
(3)氢气被氧化,应为原电池负极反应,结合电极方程式计算消耗氢气的体积.
解答 解:(1)黑磷比白磷稳定,则黑磷能量较低,白磷转化为黑磷为放热反应,应为A图象,故答案为:A;
(2)n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出890KJ的能量,所以热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1;
(3)氢气被氧化,应为原电池负极反应,在碱性条件下,电极反应式为H2-2e-+2OH-═2H2O,电路每转移0.2mol电子,则消耗0.1mol氢气,标准状况下消耗H2的体积是0.1mol×22.4L/mol=2.24L,
故答案为:负;H2-2e-+2OH-═2H2O;2.24.
点评 本题考查较为综合,涉及化学反应与能量、燃烧热的计算以及原电池知识,为高频考点,侧重于学生的分析、计算能力的考查,注意把握电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| B. | 用氢氧化铁胶体进行电泳实验时,阴极区域颜色加深,说明氢氧化铁胶体带正电荷 | |
| C. | 含Fe元素的质量分数为70%的铁红一定是纯净物 | |
| D. | 在干冰晶体中,每个CO2分子周围与之最接近而且距离相等的CO2分子有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ,其反应类型是消去反应.
,其反应类型是消去反应. .
.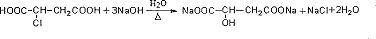 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2═SO2(g);△H1 S(g)+O2═SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
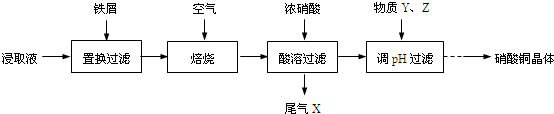
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉中加碘水后变蓝 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 蛋白质水解能得到氨基酸 | |
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 由苯制硝基苯 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.8mol•L-1•s-1 | B. | v(A2)=60mol•L-1•min-1 | ||
| C. | v(AB3)=1.0mol•L-1•s-1 | D. | v(B2)=1.2mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com