某溶液中含Ag+、Pb2+、Ba2+、Sr2+,其浓度均为0.10mol?L-1。如果逐滴加入K2CrO4稀溶液(体积变化忽略不计),通过计算说明上述多种离子的铬酸盐开始沉淀的顺序。
已知:Ag2CrO4、PbCrO4、BaCrO4、SrCrO4的溶度积分别为1.1×10-12mol3?L-3、2.8×10-13mol2?L-2、1.2×10-10mol2?L-2、2.2×10-5mol2?L-2。
见分析
【试题分析】
Ag
+沉淀所需
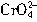
的最小浓度为:
[
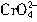
]Ag
+=
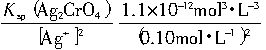
=1.1×10
-10mol?L
-1依次计算Pb
2+、Ba
2+、Sr
2+沉淀所需
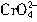
的最小浓度:
[
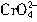
]Pb
2+=
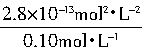
=2.8×10
-12mol?L
-1[
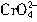
]Ba
2+=
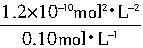
=1.2×10
-9mol?L
-1[
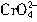
]Sr
2+=
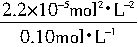
=2.2×10
-4mol?L
-1所需
浓度越小,越先沉淀,则它们开始沉淀的先后顺序为:PbCrO
4→Ag
2CrO
4→BaCrO
4→SrCrO
4。
