
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
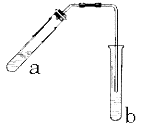
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序用操作是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是
。
(3)实验中加热试管a的目的是:
;
。
(4)试管b中加有饱和Na2CO3溶液,其作用是
。
(5)反应结束后,振荡试管b,静置。反应结束后,试管B内的液体分成两层,乙酸乙酯在______层(填写“上”或“下”).若分离10mL该液体混合物需要用到的主要玻璃仪器是______.
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如
图所示。
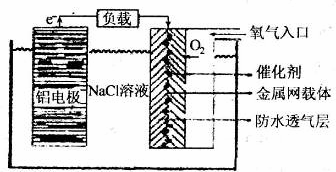
①该电池的总反应化学方程式为 ;
②电池中NaCl的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将硬脂酸甘油酯与NaOH溶液共热进行皂化反应,能把硬脂酸钠和甘油从混合物中分离出来的操作有:①盐析;②过滤;③蒸馏;④分液。其中正确的组合是( )
A.①②③ B.①③④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
检验淀粉、蛋白质、葡萄糖溶液,依次可分别使用的试剂和对应的现象正确的是( )
A.碘水,变蓝色 ;浓硝酸,变黄色 ;新制Cu(OH)2,砖红色沉淀
B.浓硝酸,变黄色 ;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色
C.新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色
D.碘水,变蓝色 ;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果酸的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
D. 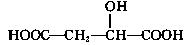 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知空气-锌电池的电极反应:锌片:Zn-2OH--2e- = ZnO + H2O,
石墨:1/2 O2+H2O +2e- = 2OH-,据次推断锌片是
A.负极,被氧化 B.负极,被还原 C.正极,被氧化 D.正极,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
部分中学化学常见元素原子结构及性质如表所示:
| 序号 | 元素 | 结构及性质 |
| A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
| B | B原子最外层电子数是内层电子总数的1/5 | |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
23.A元素在周期表中的位置为____________________________________________。
24.B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
25.①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是___________________________________________________
________________________________________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
26.C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱
________________________________________________________________________。
27.有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com