
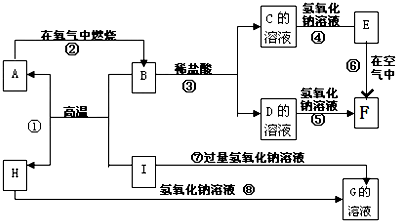
分析 F是红褐色难溶于水的沉淀,则F为Fe(OH)3,结合转化关系可知,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,H为主族元素的固态氧化物,能与氢氧化钠溶液反应生成G,且I与能与氢氧化钠溶液反应生成G,可知反应①为铝热反应,则I是Al,H是Al2O3,G是NaAlO2,据此解答.
解答 解:F是红褐色难溶于水的沉淀,则F为Fe(OH)3,结合转化关系可知,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,H为主族元素的固态氧化物,能与氢氧化钠溶液反应生成G,且I与能与氢氧化钠溶液反应生成G,可知反应①为铝热反应,则I是Al,H是Al2O3,G是NaAlO2.
(1)A、B、C、D、E、F六种物质中所含的同一种元素是Fe元素,铁元素位于第四周期第Ⅷ族,故答案为:第4周期Ⅷ族;
(2)由上述分析可知,C为FeCl2,H是Al2O3,故答案为:FeCl2;Al2O3;
(3)反应①是高温下铝和四氧化三铁反应生成氧化铝和铁,反应方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
反应⑥是氢氧化亚铁被氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
反应③是四氧化三铁与盐酸反应生成氯化亚铁、氯化铁与水,反应离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,
反应⑦铝和氢氧化钠反应生成偏铝酸钠和氢气,其离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe3O4+8H+═Fe2++2Fe3++4H2O;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)反应⑥过程中的现象是:有白色沉淀迅速变成灰绿色,最终变为红褐色,
故答案为:有白色沉淀迅速变成灰绿色,最终变为红褐色.
点评 本题考查无机物的推断,“F的颜色及I、H能与氢氧化钠反应”是推断突破口,再结合转化关系推断,侧重度化学用语的考查,难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| 实验编号 | 实验步骤 | 实验现象 |
| ② | 加入AgNO3溶液 | 有沉淀产生 |
| ③ | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的离子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的离子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极是Ag2O,负极是Zn | |
| B. | 该电池负极的电极反应式为:Zn+2OH--2e-═ZnO+H2O | |
| C. | 理论上该电池工作一段时间后,溶液中KOH的浓度不变 | |
| D. | 该电池工作时,电解质中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
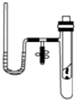 某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
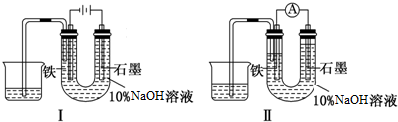
| A. | 装置I中石墨电极处得到气体的体积比铁电极处得到气体的体积大 | |
| B. | 用装置Ⅱ进行实验时铁电极的电极反应为 Fe-2e-+2OH-═Fe(OH)2↓ | |
| C. | 用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-═H2↑ | |
| D. | 装置I通电10分钟后,溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
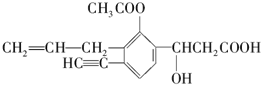 某有机化合物结构如下,分析其结构并完成下列问题:
某有机化合物结构如下,分析其结构并完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com