
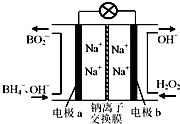
 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从a极区移向b极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
分析 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理和解答该题.
解答 解:A.正极材料采用MnO2,电极b为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,故A错误;
B.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故B正确;
C.正极电极反应式为H2O2+2e-=2OH-,每消耗3molH2O2,转移的电子为6mol,故C错误;
D.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故D正确;
故选BD.
点评 本题考查原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,题目难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 常温常压下,18 g H2O中含有2nA个氢原子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 浓硫酸在常温下不能与铜片反应放出二氧化硫气体 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| B. | 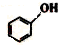 和 和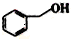 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 | |
| C. | 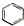 和 和 均是芳香烃, 均是芳香烃,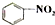 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. | 分子式为C3H6有机物最多存在4个C-C单键,与C5H12的碳碳单键数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
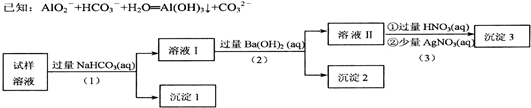
| A. | 试样溶液中若(1)加入的是稍过量的FeCl3溶液,则沉淀1物质的成分不变 | |
| B. | 试样溶液中肯定存在阴离子A1O2-、C1-,阳离子NH4+、K+至少存在1种 | |
| C. | 上述沉淀2放置在干燥空气中一段时间后,称量质量没有变化,可判断试样中无SO32- | |
| D. | 实验中,如果将操作(1)与(3)所加的试剂互换,过程中的实验现象仍会完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,但它的氧化能力很强 | |
| B. | S在纯净的氧气中易被氧化为SO3 | |
| C. | 在氯酸钾溶液中含有少量自由移动的氯离子 | |
| D. | 22.4LCl2(标准状况),在反应中总是转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H20(l)△H=-571.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g金属钠在一定条件下生成Na2O和Na2O2的混合物时,钠失去的电子数目为0.1NA | |
| B. | 22.4L氧气中所含的分子数目为NA | |
| C. | 1mol/L Na2CO3溶液中含有Na+离子数目是NA | |
| D. | 17g氨气中所含氢原子数目为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com