
【题目】某课外活动小组为了测定某(CuCl22H2O)样品的纯度,设计了如下方案:称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定样品的纯度。请回答下列问题:
(1)判断滴定达到终点的现象是___________________。
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果_____________(选填“偏高”、“偏低”或“无影响”)。
(3)若到达滴定终点时,用去KSCN标准溶液20.00mL,求此样品的纯度__________。
【答案】 由黄色变为血红色,且半分钟内不变色(或者只说出现血红色,半分钟内不变色也可以) 偏高 85.5%
【解析】(1)反应过程中用含Fe3+的溶液作指示剂,用KSCN标准溶液滴定剩余的AgNO3,滴入最后一滴后,溶液由黄色变为血红色,且半分钟内不变色,证明反应达到终点,故答案为:溶液由黄色变为血红色,且半分钟内不变色;
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高,即n(Cl-)的测定结果偏高,故答案为:偏高;
(3)根据关系式KSCN~AgNO3可知,过量的AgNO3的质量为0.2 mol/L×0.02 L×170g/mol=0.68g,则根据:CuCl22H2O~2AgNO3,可知样品中CuCl22H2O的质量为: ![]() =0.855g,则原CuCl22H2O晶体的纯度为
=0.855g,则原CuCl22H2O晶体的纯度为![]() ×100%=85.5%,故答案为:85.5%。
×100%=85.5%,故答案为:85.5%。


科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 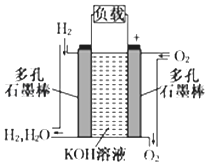
(1)通入氢气的一极为极.
(2)写出氢氧燃料电池工作时正极电极反应方程式: .
(3)该氢氧燃料电池每转移0.3mol电子,消耗标准状态下L氧气.
(4)若将此燃料电池改进为直接以甲醇(CH3OH)和氧气为原料进行工作时,负极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可减缓金属的腐蚀,延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
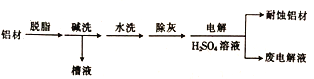
①碱洗的目的是除去铝表面的自然氧化膜(Al2O3),有关反应的离子方程式为_________________。碱洗时常有气泡冒出,该气体是_________ (填化学式)。
②电解时,处理好的铝材应与电源的________极相连,铝材表面形成氧化膜的电极反应式为_______。
(2)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_________;在酸性很弱或中性条件下,其发生_______(填“析氢腐蚀”或“吸氧腐蚀”)。
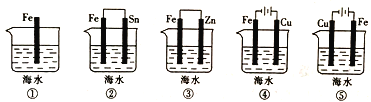
(3)下列装置中铁片腐蚀由快到慢的顺序是____________(用序号表示)。
(4)利用如图装置,可以模拟铁的电化学防护。
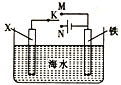
若X为碳棒,开关K置于N处,该电化学防护法称为______;若X为锌棒,开关K置于M处,_____(填“能”或“不能”)达到防止铁腐蚀的目的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,用0.1000mol/LCH3COOH溶液滴定NaOH溶液,达到滴定终点时,溶液中各离子浓度从大到小的顺序为________;为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是________(填序号)
A、石蕊 B、甲基橙 C、酚酞 D、甲基橙或酚酞
(2)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为C1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为C2,则C1/C2=________。
(3)已知H2A的电离方程式为:H2A=H++HA-;HA-![]() H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
(4)已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是________。
(5)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为__________________(用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.5g铁铝混合物粉末加入过量的1L1mol/L HNO3溶液中,充分反应后,得3.36L(标准状况)NO气体,求
(1)假设反应前后溶液的体积不变,剩余硝酸的浓度为mol/L
(2)混合物中铝的质量分数为%,
(3)向反应后的溶液中加入mL 1mol/L NaOH溶液时,生成的沉淀量最大,再加mL 1mol/L NaOH溶液才能使沉淀的量不再发生变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[已知常温下Kb(NH3H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。下列叙述正确的是

A. 0.1 mol·L-1HR溶液的pH约为3
B. HR为弱酸,常温时Ka (HR) =1×l0-7
C. 当通入0.1molNH3 时,c(R-) >c(NH4+)
D. 当c(HR) =c(R-)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,说明该反应的△H<0
B. 0.1mol/L的CH3COONa溶液加水稀释后,溶液中![]() 的值减小
的值减小
C. 常温常压下,4.4gCO2与足量Na2O2完全反应生成O2分子数为6.02×1022个
D. 用pH均为2的盐酸和甲酸中和等物质的量的NaOH溶液,盐酸消耗的体积多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)10s内,用Z表示的反应速率为_________________。
(2)10s内,X的物质的量浓度减少了__________,反应的化学方程式为_____________________,10s内,Y的转化率为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com