
| A. | H:F | B. | 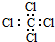 | C. | 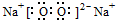 | D. | 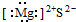 |
分析 A、氟化氢是共价化合物;
B、四氯化碳为共价化合物,应表示出各原子的最外层电子;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、简单阳离子的电子式为其离子符号本身.
解答 解:A、氟化氢是共价化合物,应标出各原子的最外层电子,故电子式为 ,故A错误;
,故A错误;
B、四氯化碳为共价化合物,应表示出各原子的最外层电子,故四氯化碳的电子式应为: ,故B错误;
,故B错误;
C、过氧化钠由2个钠离子和1个过氧根构成,故过氧化钠的电子式为: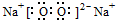 ,故C正确;
,故C正确;
D、简单阳离子的电子式为其离子符号本身,阴离子表示出最外层电子,故MgS的电子式为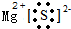 ,故D错误.
,故D错误.
故选C.
点评 本题考查了常见化合物的电子式的书写,难度不大,应注意的是电子式书写之前显判断是离子化合物还是共价化合物.


科目:高中化学 来源: 题型:实验题
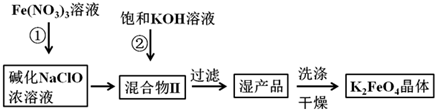
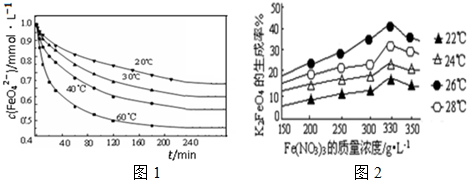
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一段时间负极质量明显减轻 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 只有正极上有氢气逸出,正极电极反应式为:2H++2e-═H2↑ | |
| D. | 正极附近的SO42-离子浓度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
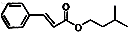 )是一种香料,一种合成路线如图:
)是一种香料,一种合成路线如图:
 ;
;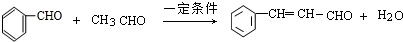 .
.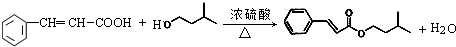 ,反应类型为酯化反应或取代反应.
,反应类型为酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
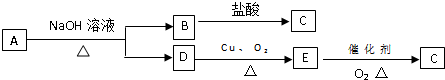
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
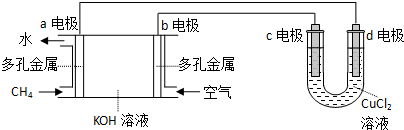
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:K>Na>Li | B. | 酸性:HClO3>H2SO4>H3PO4 | ||
| C. | 还原性:I->Br->Cl- | D. | 氧化性:F2>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
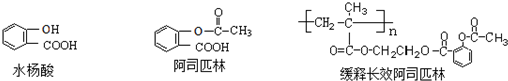
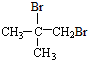 .
.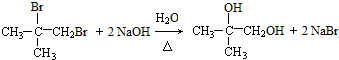 ;
;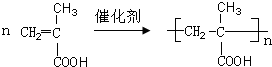 .
.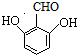 、
、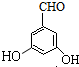 、
、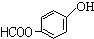 (任写一个).
(任写一个).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试剂或操作 | |
| 鉴别乙醇和乙酸 | 紫色石蕊试液(Na2CO3溶液、NaHCO3溶液) |
| 鉴别棉花和蚕丝 | 灼烧 |
| 除去乙烷中混有的乙烯 | 溴水(溴的CCl4溶液) |
| 除去苯中溶解的溴单质 | NaOH溶液 |
| 海水淡化 | 蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com