
| 物质 T/℃n/mol T/℃ | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
| Ksp |
| c(CO 3 2-) |
| 0.02mol |
| 2L |
| 0.04mol |
| 2L |
| 0.08mol |
| 2L |
| (0.04mol/L) 2×0.02mol/L |
| (0.01mol/L)2(0.01mol/L)2 |
| Ksp |
| c(CO 3 2-) |
| x |
| 2 |
| 2.8×10 -9 | ||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
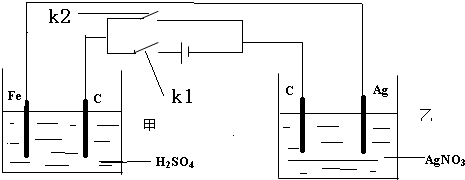
查看答案和解析>>
科目:高中化学 来源: 题型:
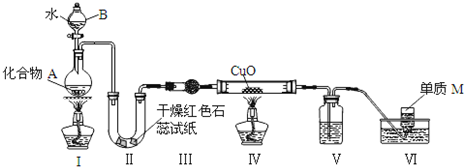
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2mol |
| B、1.5mol |
| C、1.8mol |
| D、2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
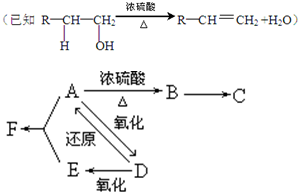
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S溶液 |
| B、KI溶液 |
| C、NaOH溶液 |
| D、Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家经研究证实光可诱发如图所示化学变化:这一事实可解释人眼的夜视功能.有关X、Y的叙述中不正确的是( )
科学家经研究证实光可诱发如图所示化学变化:这一事实可解释人眼的夜视功能.有关X、Y的叙述中不正确的是( )| A、X和Y互为同分异构体 |
| B、X和Y都可溶于水 |
| C、X和Y都可发生加聚反应 |
| D、X和Y的所有原子都可能处于同一平面内 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com