
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比为( )
A. 29∶8∶3 B. 22∶1∶14 C. 13∶8∶29 D. 26∶16∶57
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下图中甲曲线表示在最适温度下,某种酶促反应速率与反应物浓度之间的关系。其余两条曲线分别表示该酶促反应的反应速率受温度和pH的影响情况。回答下列问题:

(1)甲曲线中,若在A点适当提高温度,反应速率将会_____________________;在B点适当增加酶的浓度,反应速率将会__________________。
(2)丙曲线中,H点代表该酶的_____________________。
(3)若想要短期保存该酶,应选择曲线中的________点所对应的温度。
(4)探究温度对酶活性的影响时,通常选择_________________________(填“淀粉酶”或“过氧化氢酶”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含KCN,其浓度为0.01molL﹣1 , 现用氯氧化法处理,发生如下反应(化合物中N化合价均为﹣3价):
(1)KCN+2KOH+Cl2═KOCN+2KCl+H2O被氧化的元素是 . (用元素符号表示)
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+Cl2+═K2CO3+N2+KCl+ .
(3)若将10L含KCN的浓度为0.01molL﹣1的废水中KCN氧化除去,最少需要氯气mol.
(4)某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定.现实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣ , 因此Na2S2O3常用作脱氯剂,该反应的离子方程式为 .
(6)现取(3)中溶液20.00mL,用amolL﹣1 Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为molL﹣1 (用含a、b的表达式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在银锌原电池中,以硫酸铜为电解质溶液,锌为极,电极上发生的是反应(“氧化”或“还原”),电极反应式为 , 锌片上观察到的现象为;银电极上的电极反应式是 , 银片上观察到的现象是 . 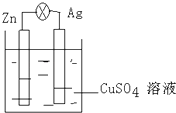
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是
A.反应物分子必须碰撞才有可能发生反应
B.发生有效碰撞的分子具有最高的能量
C.有效碰撞是活化分子在一定方向上的碰撞
D.活化分子的平均能量称之活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题: 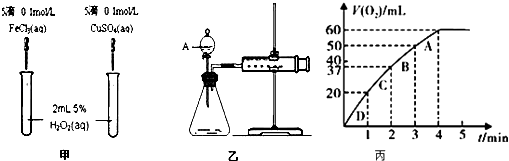
(1)定性分析:如图甲可通过观察现象,定性比较得出结论.有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为 , 实验中需要测量的数据是 .
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示. ①实验时放出气体的总体积是mL.
②A、B、C、D各点反应速率快慢的顺序为>>> .
③解释反应速率变化的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 . 回答下列问题: 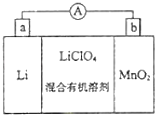
(1)外电路的电流方向是由极流向极(填字母).
(2)电池正极反应式 .
(3)是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是 .
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4 , 反应的化学方程式为 . K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5﹣3 | +7﹣1 | +6﹣2 | +3 |
(1)Z离子的结构示意图为 .
(2)关于Y、Z两种元素,下列叙述正确的是(填序号). a.简单离子的半径 Y>Z
b.气态氢化物的稳定性Y比 Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e﹣分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是 . 一段时间后,观察到试管中的现象是 , 发生反应的离子方程式是 . 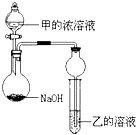
(4)T,X两种元素形成XT5固体,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,则其电子式为 .
(5)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M中元素X的化合价为 .
(6)常温下,Z2Y2是一种橙黄色液体,广泛用于橡胶工业的硫化机,其分子结构与双氧水分子相似.试写出其结构式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com