
【题目】溴与氢气在一定条件下反应的热化学方程式如下:
①Br2(g)+H2(g)2HBr(g) △H=-Q1kJ·mol-1
②Br2(l)+H2(g)2HBr(g) △H =-Q2kJ·mol-1
下列说法正确的是
A.Q1<Q2
B.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g)2HCl(g) △H >-Q1kJ·mol-1
D.向1molBr2(g)中加入1molH2(g)在该条件下充分反应,放出Q1kJ热量
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的8种元素,完成下列小题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素①的元素符号是__________, 元素⑤的原子结构示意图为____________。
(2)元素②的简单氢化物的化学式为__________,此氢化物遇元素⑧的氢化物时,会产生大量的____________(填现象)
(3)题目所给的8种元素中,金属性最强的元素是___________(填元素名称),非金属性最强的元素是_______(填元素名称),最高价氧化物对应水化物具有两性的是_______(填化学式,下同),最高价氧化物对应水化物碱性最强的是________,元素②和③的简单氢化物较稳定的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
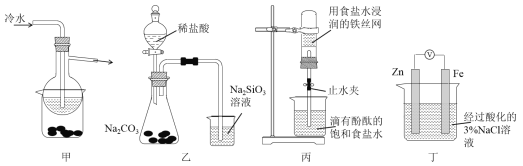
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径与原子序数的关系如下图,下列说法错误的是( )
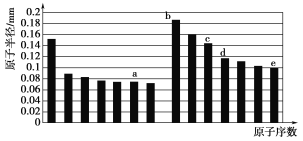
A. a、e两种元素的气态氢化物的沸点相比,前者较高
B. c、e两种元素的离子半径相比,前者较小
C. 由a与d两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. c的氧化物能溶于b的氢氧化物的水溶液和e的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,四边形![]() 内接于
内接于![]() ,
,![]() ,连接
,连接![]() 、
、![]() 交于点
交于点![]() .
.

(1)如图![]() ,求证:
,求证:![]() ;
;
(2)如图![]() ,过点
,过点![]() 作
作![]() 于点
于点![]() ,若
,若![]() ,求证:
,求证:![]() ;
;
(3)如图![]() ,在(2)的条件下,作
,在(2)的条件下,作![]() ,
,![]() 交
交![]() 于点
于点![]() ,
,![]() 交
交![]() 于点
于点![]() ,且
,且![]() ,若
,若![]() ,
,![]() ,求
,求![]() 的半径.
的半径.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为探究传统的Al—空气—海水电池,设计了如图所示的实验装置。该电池工作时,下列说法正确的是( )
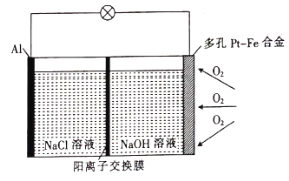
A.多孔Pt—Fe合金电极有利于吸附O2
B.负极的电极反应式为![]()
C.若反应中消耗5.4 g Al,则消耗3.36 L O2
D.当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
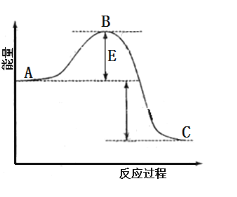
【题目】SO2是大气污染物之一,也是重要的化工原料。
(1)某温度下,反应![]()
![]() 的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
(2)将0.1 mol O2和0.2 mol SO2通入一容积可变的容器中进行反应:![]() 。测得SO2的平衡转化率随温度、压强的变化如图。
。测得SO2的平衡转化率随温度、压强的变化如图。
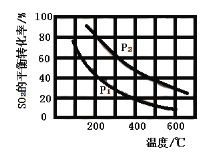
①![]() ______(填“>”“<”或“=”)
______(填“>”“<”或“=”)![]() 。
。
②若在300℃、压强为![]() 时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
③反应![]() 在
在![]() 时刻达到平衡后,在
时刻达到平衡后,在![]() 时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
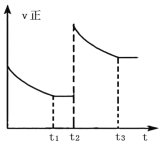
A.加压B.向体系中再通入一定量SO2
C.升高温度D.加催化剂
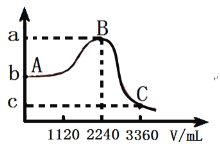
(3)常温下,向1L![]() 的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则
的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则![]() _____;
_____;![]() _____;
_____;![]() _____。已知:常温下,氢硫酸的
_____。已知:常温下,氢硫酸的![]() 、
、![]() ,亚硫酸的
,亚硫酸的![]() 、
、![]() ;
;![]() 。
。
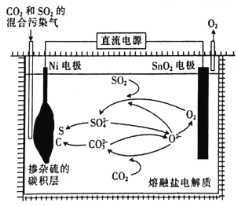
(4)用电解法处理CO2和SO2的混合污染气的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层,则与Ni电极相连的是电源的______(填“正极”或“负极”);阳极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁(FePO42H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是_____.
(2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,下列实验条件控制正确的是_____(填字母编号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),搅拌、过滤、洗漆、干燥得到FePO42H2O.若反应得到的FePO42H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为_____.
(4)实验过程中用H2O2氧化Fe2+之前,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式为:CrO![]() +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、_____和_____.
②若滴定x mL含Fe2+的滤液消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=_____ molL﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硫酸亚铁晶体步骤如下:取洁净铁屑于烧杯中,加入一定量的稀硫酸,在50℃水浴中加热一段时间,趁热过滤,滤液转移至锥形瓶中,置于冰水浴中冷却,经一系列操作后获得产品。下列说法不正确的是( )
A.反应过程中烧杯底部一般保留少量铁屑以提高产品纯度
B.硫酸溶液浓度过低会降低晶体产率
C.水浴加热可以加快反应速率同时避免生成的![]() 发生爆炸
发生爆炸
D.与室温冷却相比,冰水浴冷却滤液可以更快获得更多更大的晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com