
下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
| 实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
(1)8 g CH4的物质的量为 ,在标准状况下所占的体积约为 ;
(2)100mL 1 mol·L-1Al2(SO4)3溶液中含Al3+离子 mol,含SO42-离子 个。
(3)0.6mol O2与0.4mol O3质量之比为 ,分子个数之比为 ,原子个数之比 ,它们在同温同压下的体积比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为______。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是______(填编号)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入lL一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5mol/L、c(Cu2+)=0.3mol/L、c(Al3+)=0.2mol/L、c(NO3-)=2mol/L,则混合物中铁的质量为______。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______ (精确至0.01)。
(5)Na-AI/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为:2Na++FeS+2e-=Na2S+Fe,则电池的负极反应式可表示为_____;充电时,阳极发生反应的物质是______。
②用该电池作电源,组成如图所示装置,若通电5min时,铜电极质量增加1.08 g,则该电源电极X名称为______。图中装置A、C的pH变化为:A ______、C ______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
⑴此浓盐酸的物质的量浓度是多少?(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号): 。
①计算 ②装瓶③用50 mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向两烧杯中加入相同体积的1.5mol/L的稀硫酸,置于天平的左右两托盘上,调节天平,使之达到平衡,向一个烧杯中加入5.4g镁,另一个烧杯中加入5.4g铝,试根据计算进行分析,当硫酸取不同体积时,反应完毕后,天平可能会发生的变化。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向100ml 1mol/L 的Al2(SO4)3 溶液中加入100ml NaOH溶液,得到7.8克白色沉淀,请问NaOH溶液物质的量浓度可能是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知NaCl(s)+H2SO4(浓) NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求:
NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求:
(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于水中,配成500mL盐酸溶液,则盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有一块表面被氧化成氧化钠的金属钠,质量是10.8g,将它投入到100g水中完全反应后,收集到0.2g氢气,得到密度为1.106g/cm3的溶液,试计算(要求写过程):
(1)10.8g固体中,金属钠的质量是多少克?
(2)反应后所得溶液中溶质的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
①配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
②若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
已知:4NH3+O2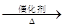 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3
(2)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气_____________mol。
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________
(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。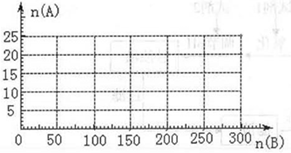
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com