
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196 kJ·mol-1。
2SO3(g) ΔH=-196 kJ·mol-1。
(1)该反应的平衡常数表达式为K=________________;某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)________v(逆)(填“<”“>”或“=”)
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极反应式________________________________________________________________________。
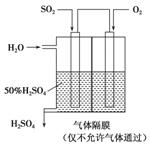
(5)为稳定持续生产,硫酸的浓度应维持不变,则通入SO2和水的质量比为________。
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
下述对乙烯和聚乙烯的描述不正确的是 ( )
A.乙烯是纯净物,常温下为气态,聚乙烯为固态,是混合物
B.乙烯和聚乙烯性质均活泼,易发生加成反应
C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
D.取等物质的量的乙烯和聚乙烯,完全燃烧后生成的CO2和H2O的物质的量分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种分离乙醇、乙酸的方案中最佳的一组是( )
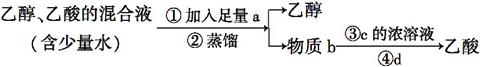
| a | b | c | d | |
| A | Na2CO3饱和溶液 | 乙酸钠 | 硫酸 | 蒸馏 |
| B | Na2CO3固体 | 乙酸钠 | 盐酸 | 过滤 |
| C | CaO固体 | 乙酸钙 | 盐酸 | 过滤 |
| D | CaO固体 | 乙酸钙 | 硫酸 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
如图是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的是证明CO具有还原性的实验装置。
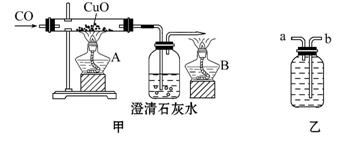
(1)实验时应先点燃 (填“A”或“B”)处的酒精灯。
(2)硬质试管中反应的化学方程式为 。
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图是他设计的贮气瓶,尾气应从 (选“a”或“b”)口通入(其他装置略)。
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要 ,理由是 。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应平衡常数与温度的关系如下:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在隔热的容器中快速混合,并不断搅拌,用温度计测量混合液的最高温度
B.往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2
C.将溴乙烷与氢氧化钾混合液加热,再滴加硝酸 银溶液,观察有淡黄色沉淀生成,可证明溴乙烷中含有溴
银溶液,观察有淡黄色沉淀生成,可证明溴乙烷中含有溴
D. 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是 。
(2)用MnO2制KMnO4的工艺流程如图
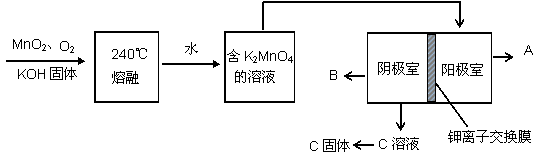

电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (写化学式,下同),可以循环使用的物质是 。
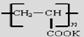 ④钾离子交换膜的一种材料是聚丙烯酸钾( ),聚丙烯酸钾单体的结构简式为 。
④钾离子交换膜的一种材料是聚丙烯酸钾( ),聚丙烯酸钾单体的结构简式为 。
上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的纯度是 (精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.(2011·广东高考)纤维素和淀粉遇碘水均显蓝色
B.(2011·广东高考)蛋白质、乙酸和葡萄糖均属于电解质
C.(2011·福建高考)蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
D.(2012·江苏高考)向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出,蛋白质均发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g)
ΔH=+183 kJ/mol
D.此反应的热化学方程式为: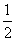 H2(g)+
H2(g)+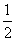 Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol
Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com