
| A. | 反应中共消耗1.75 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |
分析 Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,
稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算.
解答 解:生成气体的物质的量为$\frac{33.6L}{22.4/mol}$=1.5mol,溶液剩余硫酸的物质的量为$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气.
A.由以上计算可知,反应中共消耗1.8molH2SO4,故A错误;
B.气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4,故B正确;
C.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,故C错误;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4(稀)=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,故D错误.
故选B.
点评 本题考查方程式的相关计算,侧重于学生的分析、计算能力的考查,题目难度不大,注意浓硫酸和稀硫酸性质的不同,从质量守恒的角度解答该题,计算生成气体的物质的量关系是解答该题的关键.


科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 固体氯化铵和消石灰混合并加热 NH4++OH-═MH3↑+H20 | |
| B. | 氨水通人过量的二氧化碳 NH3•H20+CO2═NH4++HCO3- | |
| C. | 磷酸二氢钙溶液中加入过量的氢氧化钙 2H2PO4-+3Ca2++40H-═Ca3(PO4)2↓+4H2O | |
| D. | 硫化亚铁与盐酸反应 S2-+2H+═H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、食醋和味精是常用的食品添加剂,其主要成分均属钠盐 | |
| B. | SO2、CO2、NO2均被列入我国空气质量报告的指标 | |
| C. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| D. | 家用84消毒液可用来漂白衣物,为了增强其漂白效果,使用时可加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | 2 min内A的反应速率为0.3 mol/(L•min) | |
| C. | B的转化率为40% | |
| D. | 若混合气体的密度不变,则表明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )
四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①=②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
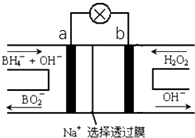 硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )| A. | 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 | |
| B. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 电池放电时Na+从b极区移向a极区 | |
| D. | 电池的负极反应为BH4-+2H2O-8e-═BO2-+8H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com