
【题目】碘的熔、沸点低,其原因是( )
A. 碘的非金属性较弱 B. I—I键的键能较小
C. 碘晶体属于分子晶体 D. I—I共价键的键长较长
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素。已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物。化合物a~g的转化关系如图所示(部分产物己略去)。下列说法正确的是( )

A. 简单离子半径的大小:C>D>B
B. a中只含非极性共价键,属于共价化合物
C. B的氢化物的稳定性和沸点均大于A的氢化物
D. 工业上通过电解其氯化物的方法制取D的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则
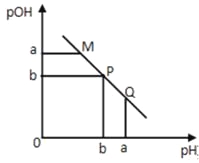
A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I是常见有机物,A是烃,E的分子式为C4H8O2,H为有香味的油状物质。

已知:CH3CH2Br+NaOH![]()
(1)0.2mol A完全燃烧生成17.6 g CO2,7.2g H2O,则A的结构简式为____________。
(2)D分子中含有官能团的名称为_____________;
(3)①的反应类型为____________
(4)G可能具有的性质为__________。
a.与钠反应 b.与NaOH溶液反应 c.易溶于水
(5)请写出②和⑦的化学方程式:
反应②_________________;
反应⑦_________________;
(6)J是有机物B的同系物,且比B多3个碳原子,J可能的结构有___种,写出其中含3个甲基可能的结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
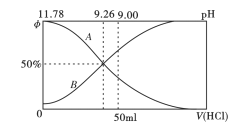
(1)表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
(2)NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置制取溴苯,回答下列问题:

(1)写出A中反应的化学方程式:_______________________;
(2)C中盛放CCl4的作用是___________________________;
(3)D中加入硝酸银溶液,实验后溶液中能看到的实验现象为_____________________;
(4)常用于鉴别苯和甲苯的试剂为_________________;
(5)E物质分子式为C8H10,且苯环上的一氯代物只有一种,则E的名称为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
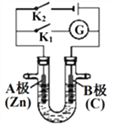
(1)断开K2,闭合K1,若所盛溶液为AgNO3溶液:则A为________极,B(石墨)极的电极反应式为________________。若所盛溶液为海水:则B极的电极反应式为______________________
(2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是___________________________________,
检验B电极上产生的物质的方法_________________________________________,
该装置中发生的反应化学方程式是___________________________________。
②反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为1.12L,将溶液充分混合,溶液的pH为_____。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。下列说法正确的是
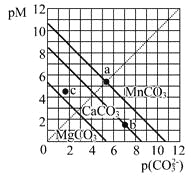
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)> c(CO32-)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com