
 .
.分析 A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,故最外层电子排布为ns2np4,故B为O元素,D为S元素,A和E元素原子的最外层电子排布为ns1,处于第ⅠA族,E为金属,E的原子序数大于S元素,故A为H元素,E为K元素,C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为3,原子序数介于O与S之间,故C为Al元素,以此来解答本题.
解答 解:A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,故最外层电子排布为ns2np4,故B为O元素,D为S元素,A和E元素原子的最外层电子排布为ns1,处于第ⅠA族,E为金属,E的原子序数大于S元素,故A为H元素,E为K元素,C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为3,原子序数介于O与S之间,故C为Al元素,则
(1)由以上分析可知A为H,B为O,C为Al,D为S,E为K,
故答案为:H;O;Al;S;K;
(2)由这五种元素组成的一种化合物是明矾,化学式为KAl(SO4)2•12H2O,主要用途是净水剂,
故答案为:KAl(SO4)2•12H2O;净水剂;
(3)D为S元素,原子价层电子排布为ns2np4,轨道表示式为: ,
,
故答案为: ;
;
(4)同主族自上而下电负性降低,故电负性O>S,金属性越强,第一电离能越小,故第一电离能Al>K,
故答案为:O>S;Al>K.
点评 本题考查结构位置与性质关系,涉及核外电子排布规律、元素周期律等知识,题目难度中等,推断元素是解题的关键,B和D的最外层电子排布是推断突破口,试题培养了学生的灵活应用能力.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+不能与SCN-形成血红色化合物 | B. | 该晶体中一定含有SCN- | ||
| C. | Fe3+的氧化性比氯气的氧化性强 | D. | Fe2+被氯气氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子的结构式是H-Cl-O | |
| B. | NaCl的电子式为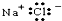 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为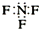 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com