
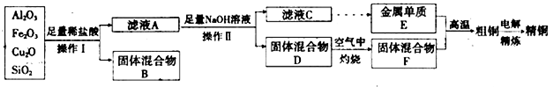
工业上用某矿渣(主要成分为Cu2O,还含有Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
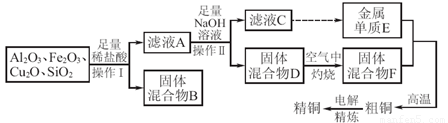
(固体混合物B经处理后可回收铜)
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)实验操作Ⅰ的名称为_________;在空气中灼烧固体混合物D时,用到多种硅酸盐材质的仪器,除玻璃棒、酒精灯、泥三角外,还有_________(填仪器名称)。
(2)滤液A中铁元素的存在形式为_______(填离子符号),生成该离子的离子方程式为_____________________。
检验滤液A中存在该离子的试剂为 (填试剂名称)。
(3)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=_______。
(4) ①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→_____________________ _______→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
(1)过滤 坩埚
(2)Fe2+ 2Fe3+ + Cu = 2Fe2+ + Cu2+ 硫氰化钾溶液和新制氯水(写化学式不给分)
(3)11 (4)①bc ②将浓硫酸用蒸馏水稀释,将样品与足量稀硫酸充分反应
【解析】
试题分析:矿渣中的Al2O3、Fe2O3均与盐酸反应,分别生成AlCl3、FeCl3,Cu2O与盐酸反应生成Cu和Cu2+,溶液中的Fe3+与Cu反应:2Fe3+ + Cu = 2Fe2+ + Cu2+,SiO2不与盐酸反应,通过过滤把Cu、SiO2与溶液分离,所以固体混合物B经处理后可回收铜,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2–,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解精炼可得纯铜。
(1)分离固体与液体的混合物采用过滤的方法,灼烧固体应放在坩埚中。
(2)由以上分析知,滤液A中铁元素的存在形式为Fe2+,生成该离子的离子方程式为2Fe3+ + Cu = 2Fe2+ + Cu2+,检验Fe2+的试剂为硫氰化钾溶液和新制氯水。
(3)设pH=a,NaAlO2溶液显碱性是由AlO2–水解所致,所以水电离出的氢氧根离子浓度为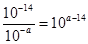 ,NaOH抑制水的电离,水电离出的OH–浓度为10–amol·L–1,
,NaOH抑制水的电离,水电离出的OH–浓度为10–amol·L–1,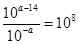 ,则2a–14 =8,a=11。
,则2a–14 =8,a=11。
(4)①电解过程中,电能除转化为化学能外,还有部分转化为热能,a项错误;电解精炼时粗铜应为阳极,与电源的正极相连,发生氧化反应,b项正确;电解时,粗铜中的铁、铝也放电,而阴极只有Cu2+得电子,所以溶液中的Cu2+浓度略有降低,c正确;根据电极反应Cu2+ + 2e– = Cu可知,阴极析出铜的物质的量是转移电子物质的量的二分之一,错误。②粗铜为Cu、Al和Fe的混合物,浓硫酸稀释后,稀硫酸可与混合物中的Al和Fe反应,而铜不反应,通过反应前后固体的质量差可测定铜的质量分数。
考点:考查实验设计、实验原理分析、离子检验、离子方程式的书写、pH计算等内容,考查信息处理能力 和综合分析能力。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源:临沂一模 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊高密市高三4月月考理综化学试卷(解析版) 题型:填空题
(1)高温电解技术能高效实现CO2(g) + H2O(g) =CO(g) + H2(g) +O2(g)? ,工作原理示意图如下:
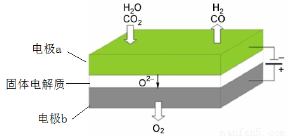
①电极b发生??????? (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是?????????????????????????????? 。
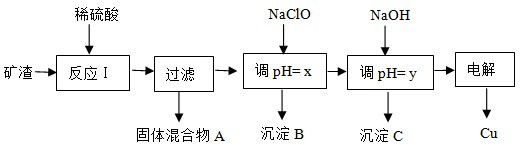
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+? = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是???????????? 。
②反应Ⅰ完成后,铁元素的存在形式为??????????? 。(填离子符号)
请写出生成该离子的离子方程式??????????????????????????????????????? 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是????????????? 。
④下列关于NaClO调pH的说法正确的是???????? (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com