
Ⅰ.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示四种微粒:A________,B________,C________,D________。
(2)写出A、B、E三种微粒反应的离子方程式:____________________________________________________。
Ⅱ.(1)CH3+、CH3-、CH3-都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH3+中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N3-叫做叠氮离子,请写出由三个原子构成的含有与N3-的电子数相同的粒子的化学式(3种)________、______、_______。
科目:高中化学 来源: 题型:填空题
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为________,D元素的原子结构示意图为_______。
(2)由A、B、C三种元素形成的化合物的电子式为________,这种化合物形成的晶体中所含的化学键类型有________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为__________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子的个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):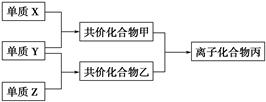
已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________________;
(2)化合物甲的电子式是____________________________________;
(3)化合物丙中存在的作用力是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.某元素有6个电子处于第三电子层d轨道上,推测该元素的原子序数是________,并根据洪特规则推测在第三电子层d轨道上未成对电子的个数是________个。
Ⅱ.核电荷数小于18的两种元素,A原子最外层电子数为a个,次外层电子数为b个;B原子M层电子数为(a-b)个,L层为(a+b)个,则:
(1)写出元素的名称和符号:A.____________________,B.____________________。
(2)写出各原子的核外电子排布的轨道表示式。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是金属元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种化合物,其白色氢氧化物在空气中会迅速变为灰绿色,最后变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。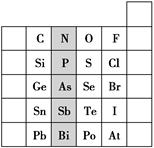
(1)阴影部分元素在元素周期表中的位置为________族。
(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?________。
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,其原因是_________________________________________。
试写出Si的氢化物完全燃烧的化学方程式:______________________________。
(4)O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式:______________________
(5)试比较S、O、F三种元素的原子半径大小:________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用
| A.质子数、 | B.中子数、 | C.最外层电子数、 | D.电子层数填写下列空格。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com