
设NA为阿伏加德罗常数的值。下列说法正确的是( )。
A.常温常压下,17 g甲基(—14CH3)所含的中子数为9 NA
B.标准状况下,11.2 L苯中含有的碳碳双键数为1.5 NA
C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3 NA
D.1 mol氯气与氢氧化钙溶液完全反应生成氯化钙和氯酸钙,转移的电子数为6 NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学题型冲刺练习 基础实验题(解析版) 题型:选择题
根据实验目的判断下列实验操作或装置正确的是( )
选项 | A | B | C | D |
目的 | 实验室制O2 | 配制稀硫酸溶液 | 在铁制品上镀铜 | 净化精制淀粉胶体 |
装置 或操作 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )。
A.将SO2通入酸性KMnO4溶液:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
B.将Na2CO3溶液滴入等浓度等体积的盐酸中:CO32-+H+=HCO3-
C.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
D.硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是( )。
A.使酚酞变红色的溶液:Fe3+、Mg2+、SO42-、NO3-
B.KNO3的酸性溶液:Fe2+、Ca2+、Al3+、Cl-
C.常温下,由水电离出的c(H+)=1.0×10-10 mol·L-1的溶液:NH4+、Na+、SiO32-、CO32-
D.透明的溶液:Cu2+、Fe3+、NO3-、MnO4-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )。
A.25 ℃,1 L pH=1的稀硫酸中含有的H+数为0.1 NA
B.标准状况下,224 mL水含有的电子数为0.1 NA
C.常温常压下,0.56 L甲烷中含有的共价健数为0.1 NA
D.0.15 mol NO2与水完全反应时转移的电子数为0.15 mol NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.3.9 g Na2O2固体中所含的离子数为0.2NA,所含的共价键数为0.05NA
B.14 g C2H4和C3H6的混合物中,所含H原子数为2NA
C.PCl3、NO2、BF3、HClO这些分子中每个原子都达到了8电子稳定结构
D.电解精炼铜时,当阳极减少3.2 g铜时,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )。
A.常温下,4 g CH4含有NA个C—H共价键
B.1 mol Fe 与足量的稀HNO3反应,转移2NA个电子
C.1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1NA 个HCO3-
D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
Mg(OH)2在水中达到溶解平衡:Mg(OH)2(s) Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
A.加入MgCl2溶液 B.加入少量NaOH
C.加入NH4NO3溶液 D.加入K2S溶液
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:填空题
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_______________________________
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
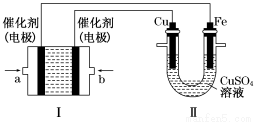
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是______________________________
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com