
分析 (1)硫化氢为多元弱酸,分步电离,以第一步为主,用可逆号;
(2)硫酸氢氨为强电解质,在水中完全电离生成氨根离子、氢离子、硫酸根离子;
(3)铜离子水解生成氢氧化铜和氢离子,用可逆号;
(4)碳酸根离子为多元弱酸的酸根离子,分步水解,以第一步为主,用可逆号;
(5)铝离子与碳酸氢根离子发生双水解生成氢氧化铝、二氧化碳.
解答 解:(1)硫化氢电离方程式:H2S?H++HS-,故答案为:H2S?H++HS-;
(2)硫酸氢氨为强电解质,完全电离,电离方程式:NH4HSO4=NH4++H++SO42-,故答案为:NH4HSO4=NH4++H++SO42-;
(3)铜离子水解生成氢氧化铜和氢离子,离子方程式:Cu2++H2O?Cu(OH)2+2H+,故答案为:Cu2++H2O?Cu(OH)2+2H+;
碳酸根离子水解的离子方程式:CO32-+H2O?HCO3-+H+,故答案为:CO32-+H2O?HCO3-+H+;
(5)铝离子与碳酸氢根离子发生双水解生成氢氧化铝、二氧化碳,离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查了离子方程式的书写,侧重考查弱电解质的电离和盐类水解,明确电解质的强弱及电离方式、盐类水解规律是解题关键,题目难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 晶胞是晶体中最小的结构基本单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都完全属于该晶胞 | |
| D. | 晶胞都是正方体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.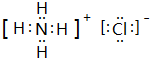 ,A2C2的电子式为
,A2C2的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入一定量的HCl气体 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入一定量6mol•L-1的硝酸溶液 | D. | 加入适量的CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的金属性:B>A;元素的非金属性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 离子半径:D2->C->B2+>A+ | |
| D. | 原子半径:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 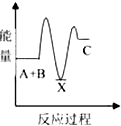 | B. | 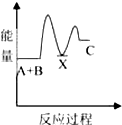 | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com