
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA |
分析 A.镁失去电子生成二价镁离子;
B.将标况下气体的体积转化为物质的量,结合1个二氧化碳分子含有2个氧原子解答;
C.1个甲醇含有1个C-O键,1个O-H,3个C-H键;
D.醋酸是弱酸,不能完全电离.
解答 解:A、2.4g镁的物质的量为$\frac{2.4g}{24g/mol}$=0.1mol,反应中失去0.2mol电子,故A错误;
B、标准状况下5.6L二氧化碳的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,含有的氧原子为0.25mol×2=0.5mol,含有的氧原子数为0.5NA,故B正确;
C、个甲醇含有1个C-O键,1个O-H,3个C-H键,共含有5个σ键,氢原子数为0.4NA的甲醇分子为0.1mol,含有0.5molσ键,故C错误;
D、醋酸是弱酸,不能完全电离,0.1L0.5mol/L CH3COOH溶液中含有的H+数小于0.05NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数,注意甲醇的结构、弱电解质电离特点,题目难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
| 有机物 | A | B | C |
| 结构(分子式)及性质 | 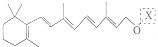 ,水解生成B和C ,水解生成B和C | 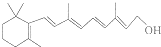 | ①分子式为C7H6O3; ②遇FeCl3水溶液呈紫色 ③与NaHCO3溶液反应产生CO2气体. |

 、
、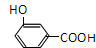 .
.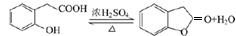 ;
;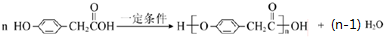 .
.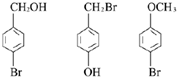 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
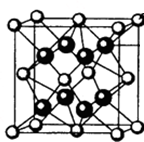 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1 CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(C{l}^{-})}$>1 | |
| D. | 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定没有离子键,离子化合物中一定没有共价键 | |
| B. | 金属原子与非金属原子间一定以共价键相结合 | |
| C. | 由不同种原子形成的纯净物一定是化合物 | |
| D. | 石墨转化成全刚石要吸收热量,石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol•L-1Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 常温常压下,22.4LCl2中含有的分子数为6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1CH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com