
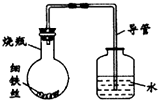
 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH4+中含质子数为11NA |
| B、1molOH-中含电子数为10NA |
| C、1molNa+中含电子数为10NA |
| D、1molF-含有的质子数与电子数之和为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑥⑦⑧ | B、①④⑤⑦ |
| C、②⑤⑦⑧ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 | 固体全部溶解则没有S生成 |
| 步骤2:取少许液体加HCl | |
| 步骤3 取少许液体加HCl和BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中,三种金属中有两种金属过量 |
| B、参加反应的金属Na、Mg、Al的物质的量之比为6:3:2 |
| C、镁的物质的量为0.1mol |
| D、V=2.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com