
����Ŀ��ij��ѧѧϰС��Ϊ��ȡ��������֤�����Ļ�ѧ���ʣ����������ʵ��װ�ã��밴Ҫ��ش����⡣��֪���Լ�ƿװ���Լ�Ϊ��B��H2S��ˮ��Һ����C��KI������Һ����D��FeBr2��Һ����E������SO2��BaCl2��Һ����F��ˮ����H����ɫʯ����Һ��
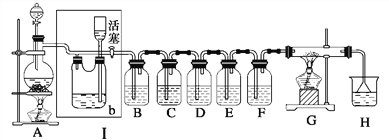
��1��A����������װ�ã��仯ѧ��Ӧ����ʽ��________________________________��
��2������bƿ�ڼ����Һ�������________��
��3��B�в�������ɫ�ĵ������������д����Ӧ�Ļ�ѧ����ʽ��______________________
��4��C�е�ʵ������Ϊ______________________
��5��D�е�ʵ������Ϊ______________________
��6��E�в�����ɫ��������������������Ӧ����д��������������ԭ��Ӧ�����ӷ���ʽ��____________________________________
��7��Gװ�õ�Ӳ�ʲ�������ʢ��̿�ۣ�����������ԭ��Ӧ�������Ϊ������̼���Ȼ�������д��G�з�����Ӧ�Ļ�ѧ����ʽ��_____________________________________��
��8��H�е�ʵ������Ϊ____________________________________________����ԭ����___________________________________________________________��
���𰸡� MnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2�� ����ʳ��ˮ H2S+Cl2=S��+2HCl ��Һ���� ��Һ��dz��ɫ��Ϊ�Ȼ�ɫ������Һ��dz��ɫ��Ϊ��ɫ������Ϊ�Ȼ�ɫ�� SO2+Cl2+2H2O=SO42��+2Cl��+4H+ C��2H2O��2Cl2
MnCl2��2H2O��Cl2�� ����ʳ��ˮ H2S+Cl2=S��+2HCl ��Һ���� ��Һ��dz��ɫ��Ϊ�Ȼ�ɫ������Һ��dz��ɫ��Ϊ��ɫ������Ϊ�Ȼ�ɫ�� SO2+Cl2+2H2O=SO42��+2Cl��+4H+ C��2H2O��2Cl2![]() CO2��4HCl ��ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ ������ˮ��Ӧ���ɵ�HClʹ��ɫʯ����Һ���ɫ�����ɵĴ�������Ư���ԣ�ʹ��ɫ��ȥ
CO2��4HCl ��ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ ������ˮ��Ӧ���ɵ�HClʹ��ɫʯ����Һ���ɫ�����ɵĴ�������Ư���ԣ�ʹ��ɫ��ȥ
�����������⿼��ʵ�鷽����������ۣ���1��ʵ�����Ʊ�Cl2������MnO2��Ũ����ķ�Ӧ����Ӧ����ʽΪMnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2������2���Ʊ��������л���HCl��ˮ������HCl���ܶԺ���ʵ��������ţ���˱����ȥ����ȥCl2��HCl�����ñ���ʳ��ˮ����b��ʢ�ŵ��DZ���ʳ��ˮ����3��������������ǿ��S����˷������ӷ�Ӧ����ʽΪCl2��H2S=S����2HCl����4��������������ǿ��I2����˷���Cl2��2I��=2Cl����I2��������ⵥ������ɫ�����ʵ����������Һ��������5����ԭ�ԣ�Fe2��>Br�������ͨ�������ȷ�����Cl2��2Fe2��=2Fe3����2Cl����Cl2��2Br��=2Cl����Br2����������Һ��dz��ɫ��Ϊ��ɫ������Ϊ�Ȼ�ɫ����6��E�в�����ɫ���������������ӷ�Ӧ����ʽΪCl2��SO2��H2O=4H����SO42����2Cl����Ba2����SO42��=BaSO4����ǰ������������ԭ��Ӧ�����߲�����������ԭ��Ӧ����7���������⣬G�з�����ѧ��Ӧ����ʽΪC��2H2O��2Cl2
MnCl2��2H2O��Cl2������2���Ʊ��������л���HCl��ˮ������HCl���ܶԺ���ʵ��������ţ���˱����ȥ����ȥCl2��HCl�����ñ���ʳ��ˮ����b��ʢ�ŵ��DZ���ʳ��ˮ����3��������������ǿ��S����˷������ӷ�Ӧ����ʽΪCl2��H2S=S����2HCl����4��������������ǿ��I2����˷���Cl2��2I��=2Cl����I2��������ⵥ������ɫ�����ʵ����������Һ��������5����ԭ�ԣ�Fe2��>Br�������ͨ�������ȷ�����Cl2��2Fe2��=2Fe3����2Cl����Cl2��2Br��=2Cl����Br2����������Һ��dz��ɫ��Ϊ��ɫ������Ϊ�Ȼ�ɫ����6��E�в�����ɫ���������������ӷ�Ӧ����ʽΪCl2��SO2��H2O=4H����SO42����2Cl����Ba2����SO42��=BaSO4����ǰ������������ԭ��Ӧ�����߲�����������ԭ��Ӧ����7���������⣬G�з�����ѧ��Ӧ����ʽΪC��2H2O��2Cl2![]() CO2��4HCl����8��������ˮ��Ӧ���ɵ�HClʹ��ɫʯ����Һ���ɫ�����ɵĴ�������Ư���ԣ�ʹ��ɫ��ȥ�������������ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ��
CO2��4HCl����8��������ˮ��Ӧ���ɵ�HClʹ��ɫʯ����Һ���ɫ�����ɵĴ�������Ư���ԣ�ʹ��ɫ��ȥ�������������ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش�����������
��1�������������ļ��������������з��������ٵ���________________����״���������С����_____________________��
��1gH2 ��2.408��1023��CH4���� ��10.8gH2O ����״����6.72LCO2
��2������ƽ����ʽ��___KClO3+____HCl��Ũ��=___KC1+____ ClO2��+___Cl2��+__H2O��__________
��3����Һ��������ȡ���������ƶ����ӵ�Ũ�Ⱥ����������������Ũ��Խ�����������Խ�࣬��Һ��������Խǿ������Ũ�Ⱦ�Ϊlmol/L�����µ������Һ����K2CO3 ��AgNO3 ��NaHSO4 ��Al2(SO4)3��H2SO4 ��Ba(OH)2����Щ��Һ�е���������ǿ����__________���������������������������____________��
��4����12.4gNa2R��Na+Ϊ0.4mol����Na2R��Ħ������Ϊ____________��
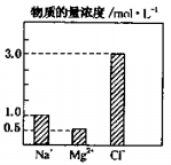
��5����0.2L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ���û����Һ��CuCl2�����ʵ���Ũ��Ϊ____________ molL-1��
��6����ͼ��ʾ�ľ�ʾ��־����һ��____________����ѡ���������
A.��ȼƷ B.�綾Ʒ C.��ʴƷ D.��ըƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.0.1 mol?L��1�Ĵ����ˮϡ�ͣ� ![]() ��С
��С
B.��ˮ�м������������������ƣ�c��H+������Kw���
C.�����pH����ͬ�Ĵ����������ȫ�ܽ������þ�ۣ�������������ʱ��
D.�����£�pH=11��NaOH��Һ��pH=3��CH3COOH��Һ�������ϣ���Һ�Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������һֱ��עʳƷ��ȫ���������˽���ҵȾ�ϡ��յ���1�š��Ƿ�����ʳ��ɫ�أ��յ�����һϵ���˹��ϳ�Ⱦ�ϣ����С��յ���4�š��Ľṹʽ��ͼ�� 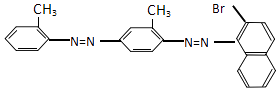 ���й��ڡ��յ���4�š�˵����ȷ���ǣ� ��
���й��ڡ��յ���4�š�˵����ȷ���ǣ� ��
A.���ܷ����ӳɷ�Ӧ
B.���ڼױ�ͬϵ��
C.���ڷ�����
D.�ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ�� 3A(g)+B(g)![]() xC(g)+2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol��L-1�������ж���ȷ���ǣ� ��
xC(g)+2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol��L-1�������ж���ȷ���ǣ� ��
A. x=2 B. A��ƽ����Ӧ����Ϊ0.6 mol��L-1��min-1
C. ƽ�ⳣ��ԼΪ0.15 D. �����������ܶȲ���������÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƕ�Ԫ��ǿ��������������Һ�����ԡ������£���10 mL 0.01 mol/LNaHC2O4��Һ�еμ�0.01 mol/L NaOH��Һ������NaOH��Һ��������ӣ���Һ������Ũ�ȹ�ϵ��ȷ����
A. V��NaOH��=0ʱ��c��H+��=1��10-2mol/L
B. V��NaOH����10mLʱ�������ܴ���c��Na+��=2c��C2O42-��+c��HC2O4-��
C. V��NaOH��=10mLʱ��c��H+��=1��10-7mol/L
D. V��NaOH����10mLʱ��c��Na+����c��C2O42-����c��HC2O4-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ס���Ϊͬ����Ԫ�أ��ش��������⣺
��1����̬Asԭ�ӵĺ�������Ų�ʽΪ ��
��2���ص���Ͻ���ϵ�̫���ܵ��Ч�ʴ�40%����3��Ԫ�صĵ縺���ɴ���С��˳��������Ԫ�ط��ű�ʾ��
��3��As4O6�ķ��ӽṹ��ͼ1��ʾ������Asԭ�ӵ��ӻ���ʽΪ �� 1mol As406���ЦҼ������ʵ���Ϊ �� 
��4�������⻯��RH3��NH3��PH3��AsH3����ij��������R�ĺ˵�����ı仯������ͼ2��ʾ����Y��ɱ�ʾ���⻯�RH3�����ʿ����� �� 
A.�ȶ���
B.�е�
C.R��H����
D.���Ӽ�������
��5��AsH3�ķе㣨��62.5�棩��NH3�ķе㣨��33.5�棩�ͣ�ԭ����
��6��NH4+�е�H��N��H�ļ��DZ� NH3�е�H��N��H�ļ��������С������ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ�������Ϣ�� ���Т١���Ϊ������Ԫ����Ҫ���ϼۼ�����⻯��е�����ݣ�
Ԫ������ | Ԫ�ر�� | |||||
�� | �� | �� | �� | �� | �� | |
�⻯��е㣨�棩 | ��33.4 | 100 | 19.54 | ��87.7 | ��60.7 | ��84.9 |
��Ҫ���ϼ� | +5 | ��2 | ��1 | +5 | +6 | +7 |
A��B��C��Ϊ�ϱ��е�Ԫ�أ�
��A��B���γɻ�����AB��AB2 �� ���߿������Ʊ�ǿ��ף�
��C��B���γɻ�����CB2��CB3 �� ���߿������Ʊ�ǿ���ң�
��ش�
��1���ñ�������Ԫ�ص��⻯��������������ͬ���������⻯��֮���ܷ�����Ӧ��д������Ҫ��Ļ�ѧ����ʽ���ж�����ϣ�д������һ�����ɣ���
��2��Ԫ�آ��⻯��ķе����Ԫ�آ��⻯��ķе㣬ԭ���� ��
��3���ס��ҷֱ��백��Ӧ���ɱ��������������Σ�0.1mol/L�ļס��ҡ�����������������Һ��pH��С�������е�˳���ǣ���д��ѧʽ�� ��
��4����ϡ�ļ���Һ��Zn��Ӧ������Ӧ�ļ���Zn�����ʵ���֮��Ϊ5��2ʱ����ԭ�������Ϊ����д��ѧʽ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ĽṹΪ��ͼ��ʾ�������л��ﲻ���ܾ��е������ǣ� �� �ٿ���ȼ�գ�����ʹ����KMnO4��Һ��ɫ��
���ܸ�NaOH��Һ��Ӧ�� ���ܷ���������Ӧ��
���ܷ����Ӿ۷�Ӧ�����ܷ���ˮ�ⷴӦ��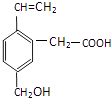
A.�٢�
B.ֻ�Т�
C.ֻ�Т�
D.�ܢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com