
【题目】已知H2的燃烧热为ΔH=-285.8 kJ·mol-1,CO的燃烧热为ΔH=-282.8 kJ·mol-1;现有H2和CO组成的混合气体5.6 L(标准状况),经充分燃烧后,放出总热量为71.15 kJ,并生成液态水。下列说法正确的是
A. CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-282.8 kJ·mol-1
B. H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1
C. 燃烧前混合气体中CO的体积分数为60%
D. 燃烧后的产物全部与足量的过氧化钠作用可产生0.125 mol O2
【答案】D
【解析】
A.通常条件下,1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,放热反应焓变为负值;
B.氢气燃烧热是1mol氢气完全燃烧生成液态水放出的热量;
C.根据氢气和一氧化碳的燃烧热与二者总物质的量列方程计算解答;
D.根据H2和CO各自的物质的量,由原子守恒得到水和二氧化碳的物质的量,再结合反应方程式计算生成氧气的物质的量。
A.一氧化碳燃烧热为282.8kJ·mol-1,根据燃烧热概念,热化学方程式为CO(g)+![]() O2(g)===CO2(g) ΔH=-282.8 kJ·mol-1,故A错误;
O2(g)===CO2(g) ΔH=-282.8 kJ·mol-1,故A错误;
B.氢气燃烧热为285.8 kJ·mol-1热化学方程式为:2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,选项中为水蒸气不是稳定的氧化物,故B错误;
C.H2和CO组成的混合气体5.6 L (标况),物质的量为![]() =0.25mol,经充分燃烧后,放出总热量为71.15 kJ,并生成液态水,根据氢气和一氧化碳燃烧热的热化学方程式计算,设氢气物质的量为x,一氧化碳物质的量为y,则x+y=0.25,285.8x+282.8y=71.15,计算得到x=0.15,y=0.1,燃烧前混合气体中CO的体积百分数=
=0.25mol,经充分燃烧后,放出总热量为71.15 kJ,并生成液态水,根据氢气和一氧化碳燃烧热的热化学方程式计算,设氢气物质的量为x,一氧化碳物质的量为y,则x+y=0.25,285.8x+282.8y=71.15,计算得到x=0.15,y=0.1,燃烧前混合气体中CO的体积百分数=![]() 100%=40%,故C错误;
100%=40%,故C错误;
D.氢气0.15mol,CO有0.1mol,则生成水和二氧化碳分别为0.15mol和0.1mol,由2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,可以知道生成氧气的物质的量为0.15mol![]() +0.1mol
+0.1mol![]() =0.125mol,所以D选项是正确的,
=0.125mol,所以D选项是正确的,
故选D。


科目:高中化学 来源: 题型:
【题目】现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。请根据以上信息回答下列问题:
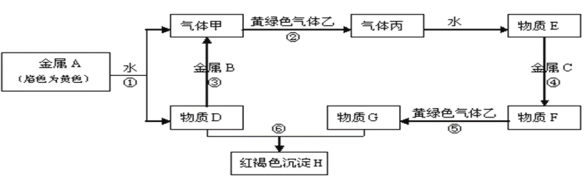
(1)ABC三种金属的还原性强弱由强到弱的顺序是:______________;(用具体化学式表示)
(2)写出反应③的离子方程式:__________________________。
(3)实验室制取乙气体时,先将气体生成物通过 _____以除去________________。
(4)向烧杯中装有的物质F中加入物质D,可以看到的现象是:_________,物质F同价态阳离子的碳酸盐在隔绝空气时加强热,可以得到红色固体,对应的化学方程式是:___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)
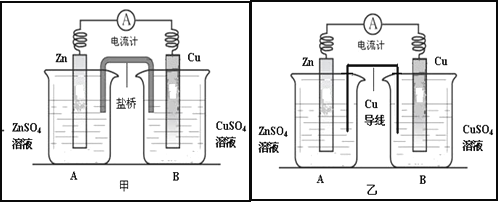
(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯(填“A”或“B”),装置中电子的移动路径和方向为___________________________。
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(2)该小组的一位成员认为溶液中的阴阳离子能通过铜导线从而构成闭合回路形成电流,该装置仍然为原电池。你对该观点的评价是_________(填“正确”或“不正确”)。
(3)对于实验中产生电流的原因,该小组进行了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池。那么在烧杯B中铜片上发生反应的电极反应式为______________________。
(4)对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的正极反应式为:_________________________________。
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的正极反应式为:_________________ 。
(5)若第(4)问中②观点正确,则可以利用此原理设计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A. 转移10NA个电子时,该反应放出1300 kJ的能量
B. 生成NA个液态水分子时,吸收1300 kJ的能量
C. 有2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 有10NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组同学用如图装置进行实验,试回答下列问题:

①若开关K与a连接,则铁发生电化学腐蚀中的_____腐蚀,石墨电极上的电极反应式为_____。
②若开关K与b连接,则电解反应的化学方程式为_____。
(2)该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如下图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为_____。
此时通过阴离子交换膜的离子数_____(选填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
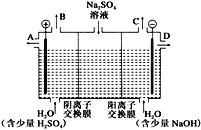
②通电开始后,阴极附近溶液pH_____(选填“增大”、“不变”或“减小”)。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为_____;已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g 液态H2O时,理论上有_____kJ的能量转化为电能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是 ( )
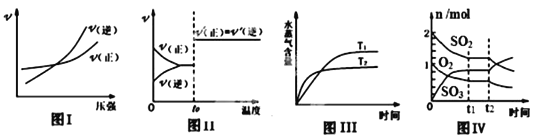
A. 图 I:反应N2+3H2![]() 2NH3在恒温情况下,反应速率与压强的关系
2NH3在恒温情况下,反应速率与压强的关系
B. 图Ⅱ:反应H2+I2![]() 2HI达平衡后,升高温度时反应速率随时间的变化
2HI达平衡后,升高温度时反应速率随时间的变化
C. 图Ⅲ:反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
D. 图Ⅳ:反应2SO2+O2![]() 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化
2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com