
 4种短周期元素相对位置如右表.M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素.回答下列问题:
4种短周期元素相对位置如右表.M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素.回答下列问题: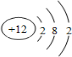 ,故答案为:
,故答案为: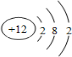 ;
;| 0.1mol×[0-(-3)] |
| 2(2-1) |
| 1.3×10-3×1.3×10-3 |
| 0.1 |


科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ?mol-1说明2 mol H2(g)和1 mol O2(g)的能量总和小于2 mol H2O(g)的能量 |
| B、已知C(s,石墨)=C(s,金刚石)△H>0,则金刚石比石墨稳定 |
| C、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含20 g NaOH的稀溶液与稀盐酸恰好完全中和,放出28.65 kJ的热量 |
| D、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2+2Y2=2X2 |
| B、2X2+Y2=2X2Y |
| C、3X2+Y2=2X3Y |
| D、X2+3Y2=2XY2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氧化铁作为红色颜料 |
| B、过氧化钠用作呼吸面具中的供养剂 |
| C、用铝制餐具长时间存放碱性食物 |
| D、明矾可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图实验产生红褐色沉淀 |
B、 如图实验溶液变红色 |
C、 如图实验试管中溶液变无色 |
D、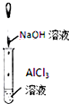 如图实验试管中先出现白色沉淀,后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,以甲为电源,用惰性电极电解饱和食盐水.下列说法中不正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,以甲为电源,用惰性电极电解饱和食盐水.下列说法中不正确的是( )| A、装置乙的a极要与装置甲的X极连接 |
| B、装置乙中b极的电极反应式为2Cl--2e-═Cl2↑ |
| C、若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、N电极发生还原反应,当N电极消耗5.6 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁是一种碱性氧化物,常用作红色油漆和涂料 |
| B、在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多 |
| C、Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 |
| D、人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com