
| A. | 乙烷(乙烯):光照条件下通入Cl2,气液分离 | |
| B. | 溴苯(液溴):用氢氧化钠溶液洗涤,分液 | |
| C. | 乙烯(SO2):气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(水):加足量浓硫酸,蒸馏 |
分析 A.光照下乙烷与氯气发生取代反应;
B.溴与NaOH反应后,与溴苯分层;
C.二者均与高锰酸钾发生氧化还原反应;
D.浓硫酸具有脱水性,可使乙醇碳化.
解答 解:A.光照下乙烷与氯气发生取代反应,将原物质除去,不能除杂,应选溴水、洗气,故A错误;
B.溴与NaOH反应后,与溴苯分层,然后分液可分离,故B正确;
C.二者均与高锰酸钾发生氧化还原反应,不能除杂,应选NaOH、洗气,故C错误;
D.浓硫酸具有脱水性,可使乙醇碳化,不能除杂,应加CaO后蒸馏,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握有机物的性质、性质差异、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意除杂的原则,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的氧化铝制取金属铝用铁作阳极 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| C. | 在镀件上镀铜时可用金属铜作阴极 | |
| D. | 除去MgCl2溶液中的CuCl2既可用MgO也可用Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 实验现象 | 结论 | |
| A | 将铝片放入盐酸中 | 产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| B | 将形状大小相近的Mg和Al片分别放入相同浓度的盐酸中 | Mg与盐酸反应比Al剧烈 | Mg比Al的金属性强 |
| C | 氢气在氯气中点燃 | 有苍白色火焰,瓶口有白雾 | 该反应为吸热反应 |
| D | 将一小块钠投入冷水中 | 钠熔化成小球 | 反应物的总能量比生成物的总能量低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
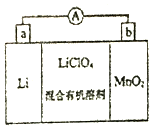 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

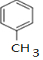 ,D中通过反应②引入的官能团名称为氯原子.
,D中通过反应②引入的官能团名称为氯原子.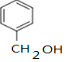 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式).
(填结构简式).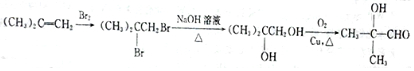 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | HCO3- | C. | OH- | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com