
| A. | 乳酸薄荷醇酯(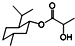 )不仅能发生氧化、消去反应,还能发生取代反应 )不仅能发生氧化、消去反应,还能发生取代反应 | |
| B. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 按系统命名法,化合物 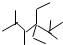 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 化合物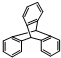 是苯的同系物 是苯的同系物 |
分析 A.含-OH,可发生氧化、消去反应,-OH、-COOC-均可发生取代反应;
B.乙醛和丙烯醛结构不相似,与氢气加成后均为饱和一元醇;
C.取代基位次之和不最小;
D.苯的同系物中只有一个苯环.
解答 解:A.乳酸薄荷醇酯中含-OH,可发生氧化、消去反应,-OH、-COOC-均可发生取代反应,故A正确;
B.乙醛和丙烯醛结构不相似,与氢气加成后均为饱和一元醇,则与氢气充分反应后的产物为同系物,故B错误;
C.取代基位次之和不最小,名称为2,2,4,5-四甲基-3,3-二乙基己烷,故C错误;
D.苯的同系物中只有一个苯环,则化合物 不是苯的同系物,故D错误;
不是苯的同系物,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意醇、酯等有机物的性质及同系物判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含SO42- | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含K+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1L pH=1的硫酸溶液中,含有H+的数目为0.1NA | |
| B. | 22.4L HCl和22.4L DCl中 所含质子数均为18NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 1 mol C3H6分子中碳碳共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

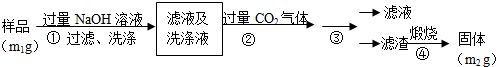
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com