
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________________,写出一种工业制备单质F的离子方程式________________________________________________________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为_______________________________________
________________________________________________________________________;
在产物中加入少量KI,反应后加入CCl4并振荡,有机层显________色。
答案 (1)第一周期 ⅠA族 2Cl-+2H2O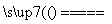 2OH-+H2↑+Cl2↑[或2NaCl(熔融)
2OH-+H2↑+Cl2↑[或2NaCl(熔融)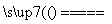 2Na+Cl2↑]
2Na+Cl2↑]
(2)纯碱(或苏打) 2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3 紫
解析 根据题目中给出的各种元素的结构特点和性质,推断出各种元素,解答各题。最外层电子数与其周期数相同的短周期非金属元素只有氢元素,A为氢元素。最外层电子数是其所在周期数2倍的短周期元素可能为碳元素或硫元素,根据B在D中充分燃烧生成的最高价化合物的化学式为BD2判定B为碳元素,D为氧元素。E+与O2-具有相同的电子数,则E为钠元素。H2在Cl2中燃烧生成的HCl溶于水得到的盐酸为强酸,F为氯元素。
(1)氢元素在周期表中的位置为第一周期ⅠA族。工业上制备Cl2可由电解饱和食盐水或电解熔融的NaCl得到,其离子方程式为2Cl-+2H2O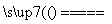 2OH-+H2↑+Cl2↑或2NaCl(熔融)
2OH-+H2↑+Cl2↑或2NaCl(熔融)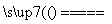 2Na+Cl2↑。
2Na+Cl2↑。
(2)C、O、Na组成的盐Na2CO3中Na的质量分数为43%,Na2CO3的俗名为纯碱或苏打,Na2CO3溶液与Cl2反应的化学方程式为2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3,产物中加入少量KI,ClO-将I-氧化为I2,I2易溶于CCl4而使有机层显紫色。


科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.在分子中,两个成键的原子间的距离叫做键长
B.H—Cl的键能为431.8 kJ·mol-1,H—I的键能为298.7 kJ·mol-1,这可以说明HCl分子比HI分子稳定
C.含有极性键的分子一定是极性分子
D.键能越大,表示该分子越容易受热分解
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
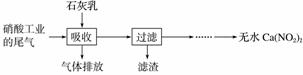
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是________________________;滤渣可循环使用,滤渣的主要成分是________(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。若n(NO)∶n(NO2)>1∶1,则会导致__________________;若n(NO)∶n(NO2)<1∶1,则会导致________________________________________________________________________。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3->D-
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是短周期元素,其部分性质如下表。
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的 |
| Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是( )
A.气态氢化物的热稳定性:X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.Z的氧化物中含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高 B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量 D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18。根据结构填空:
(1)写出元素名称:A__________,B__________,C__________,D__________。
(2)D的简单离子是________。
(3)元素的氢氧化物碱性最强的是________。
(4)B与D两原子间形成化合物的化学式是______________。
(5)写出A、B的电离能顺序:________。
(6)写出C基态原子的电子排布式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物
B.两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体
C.相对分子质量相同的几种化合物,互称为同分异构体
D.组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com